摘要:神經(jīng)退行性疾病,包括阿爾茨海默病(AD)和帕金森病(PD)是由遺傳和環(huán)境因素共同引起的高度衰弱的疾病。
神經(jīng)退行性疾病,包括阿爾茨海默病(AD)和帕金森病(PD)是由遺傳和環(huán)境因素共同引起的高度衰弱的疾病。探索這些疾病的神經(jīng)基礎(chǔ)以及人體如何典型地預(yù)防神經(jīng)變性的研究可以幫助設(shè)計更有效的治療和預(yù)防策略。
蘇黎世大學(xué)和卡羅林斯卡大學(xué)索爾納醫(yī)院的研究人員在小鼠身上進行了一項研究,旨在更好地了解NG2神經(jīng)膠質(zhì)細胞(中樞神經(jīng)系統(tǒng)中的一類神經(jīng)膠質(zhì)細胞)在朊病毒誘導(dǎo)的神經(jīng)變性中的作用。朊病毒疾病是一種神經(jīng)退行性疾病,其神經(jīng)毒性是由一種叫做朊病毒的蛋白質(zhì)的異常積聚引起的。
研究人員發(fā)表在《Nature Neuroscience》雜志上的研究結(jié)果表明,NG2膠質(zhì)細胞可以防止與朊病毒積累有關(guān)的神經(jīng)毒性和神經(jīng)變性。此外,他們還深入了解了這些細胞減輕神經(jīng)變性的機制。

圖1 NLRC5感知NAD+損耗形成泛視小體并驅(qū)動泛視癥和炎癥
“我對NG2膠質(zhì)細胞的興趣可以追溯到許多年前,當時我正在研究中樞神經(jīng)系統(tǒng)炎癥的調(diào)節(jié)機制,”該論文的合著者Yingjun Liu告訴Medical Xpress。“我們知道,我們的免疫系統(tǒng)是我們身體抵御感染和疾病的關(guān)鍵衛(wèi)士。然而,它需要嚴格控制,因為過多的免疫反應(yīng)可能對正常組織有害。”
已知外周器官(即對環(huán)境變化作出反應(yīng)的身體部位)中的特殊細胞類型有助于在處理入侵病原體或受損組織后快速解決炎癥。
令人驚訝的是,神經(jīng)科學(xué)家還沒有在中樞神經(jīng)系統(tǒng)中發(fā)現(xiàn)類似的特化細胞,盡管有報道稱神經(jīng)元對神經(jīng)炎癥期間釋放的免疫介質(zhì)敏感。
“我的懷疑是NG2膠質(zhì)細胞可能作為這樣一種細胞類型,因為它們可以像中樞神經(jīng)系統(tǒng)中的經(jīng)典免疫細胞(如小膠質(zhì)細胞)一樣快速地對免疫刺激做出反應(yīng),但不釋放促進炎癥反應(yīng)的因子,”Liu說。“除此之外,早期的研究已經(jīng)觀察到受各種神經(jīng)系統(tǒng)疾病影響的患者大腦中NG2膠質(zhì)細胞可能發(fā)生變化。然而,它們?nèi)绾斡绊懠膊∵M展尚不清楚。”
識別保護中樞神經(jīng)系統(tǒng)免受神經(jīng)毒性的細胞并不能幫助理解特定神經(jīng)退行性疾病的基礎(chǔ)。盡管如此,它可以幫助設(shè)計新的治療干預(yù)措施來治愈或預(yù)防這些疾病。
“幾年前,我們開發(fā)了一種方法,可以有效地從培養(yǎng)的腦切片和動物模型的腦組織中消除NG2膠質(zhì)細胞,并發(fā)現(xiàn)NG2膠質(zhì)細胞確實在維持健康大腦中的穩(wěn)態(tài)小膠質(zhì)細胞狀態(tài)方面起著至關(guān)重要的作用,”Liu說。“在目前的研究中,在這些方法的幫助下,我們進一步研究了NG2膠質(zhì)細胞在病理條件下的作用,方法是在朊病毒疾病的背景下操縱它們,這是一組致命的腦部疾病,可以在幾個月內(nèi)殺死病人。”
Liu和他的同事最近的研究專門探討了NG2膠質(zhì)細胞在神經(jīng)退行性朊病毒疾病出現(xiàn)中的作用。朊病毒是自然界中發(fā)現(xiàn)的蛋白質(zhì),與大腦中大量存在的一些正常蛋白質(zhì)具有相同的氨基酸序列。這基本上意味著朊病毒和某些“正常”蛋白質(zhì)是由人類基因組中相同的DNA片段編碼的。
“然而,與正常的朊病毒相比,朊病毒在3D中折疊異常,并且有能力將正常的朊病毒轉(zhuǎn)化為病理形式,”Liu解釋說。“事實上,許多腦部疾病,包括阿爾茨海默病等非常常見的疾病,都是由類似的發(fā)病機制引起的。在我們的實驗中,我們用兩個實驗系統(tǒng)模擬了朊病毒疾病。”
在他們的第一個實驗裝置中,Liu和他的同事將在孵化器中保持“活”的大腦切片暴露于朊病毒。幾周內(nèi),朊病毒引起的病理變化與提取這些培養(yǎng)物的患者大腦中觀察到的變化相似。
“這個系統(tǒng)使我們能夠快速測試科學(xué)假設(shè)和潛在的治療方法,”Liu說。
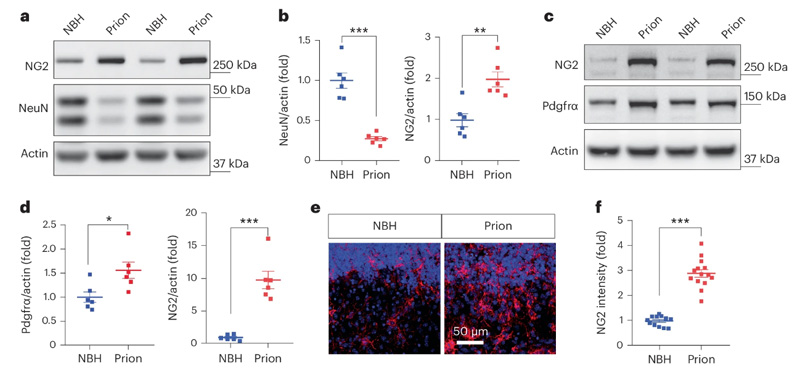
圖2 朊病毒疾病模型中NG2膠質(zhì)細胞的激活
在他們的第二個實驗中,研究人員將小鼠暴露于朊病毒中,誘發(fā)了一種模仿人類朊病毒疾病的“疾病”,具有類似的疾病軌跡。這使他們能夠測試他們的假設(shè),并評估與人類有共同之處的活體哺乳動物的潛在治療方法。
Liu說:“我們從兩個模型系統(tǒng)(即大腦切片和小鼠)中消除了NG2膠質(zhì)細胞,并將它們與具有完整NG2膠質(zhì)細胞的模型系統(tǒng)進行了比較,以了解疾病相關(guān)過程的演變。我們發(fā)現(xiàn),當缺乏NG2膠質(zhì)細胞時,疾病過程,特別是暴露于朊病毒后神經(jīng)元的死亡會加速,這表明這些細胞正在保護我們免受疾病的侵害。”
Liu和他的同事們還進行了分析,以進一步驗證他們的發(fā)現(xiàn),特別是從組織和小鼠中去除NG2膠質(zhì)細胞。他們發(fā)現(xiàn),這些細胞的移除增強了小膠質(zhì)細胞(大腦中的免疫細胞)的生物學(xué)過程,該過程負責產(chǎn)生一種稱為前列腺素E2的脂質(zhì)分子。
Liu說:“至關(guān)重要的是,之前的研究發(fā)現(xiàn),前列腺素E2水平在朊病毒疾病患者的大腦中更高,盡管前列腺素E2水平升高與疾病進展的相關(guān)性尚不清楚。因此,我們下一步研究了朊病毒疾病模型中NG2膠質(zhì)細胞消除后前列腺素E2產(chǎn)生的增強如何與神經(jīng)元死亡的增強有關(guān)。”
值得注意的是,研究人員觀察到脂質(zhì)分子前列腺素E2可以與神經(jīng)元表面的一種叫做EP4的蛋白質(zhì)結(jié)合。這引發(fā)了一個有毒的信號傳導(dǎo)過程,最終殺死了神經(jīng)元,破壞了大腦的正常功能。
“首先,我們發(fā)現(xiàn)朊病毒疾病中的NG2膠質(zhì)細胞具有神經(jīng)保護作用,”Liu說。“然后我們還發(fā)現(xiàn)NG2膠質(zhì)細胞作為小膠質(zhì)細胞中前列腺素E2生物合成的抑制因子。第三,我們發(fā)現(xiàn)大腦中過量的前列腺素E2通過與神經(jīng)元表面的EP4受體結(jié)合,增強了朊病毒對神經(jīng)元的殺傷作用。”
總的來說,該研究小組收集的結(jié)果強調(diào)了NG2膠質(zhì)細胞對朊病毒誘導(dǎo)的神經(jīng)變性的保護作用,因為這些細胞被發(fā)現(xiàn)可以抑制前列腺素E2的毒性作用。在未來,他們的工作可能有助于開發(fā)針對朊病毒疾病和其他類似形式的神經(jīng)退行性疾病的新療法。
Liu補充說:“一個有趣但仍未解決的問題是,我們?nèi)绾螌⒛壳把芯康陌l(fā)現(xiàn)轉(zhuǎn)化為最終可能對患者有幫助的東西,例如,通過增強疾病期間大腦中NG2膠質(zhì)細胞的有益作用。這將依賴于未來對疾病發(fā)病過程中控制有益NG2膠質(zhì)細胞反應(yīng)的分子機制的深入研究。”
參考資料
[1] NG2 glia protect against prion neurotoxicity by inhibiting microglia-to-neuron prostaglandin E2 signaling
摘要:神經(jīng)退行性疾病,包括阿爾茨海默病(AD)和帕金森病(PD)是由遺傳和環(huán)境因素共同引起的高度衰弱的疾病。
神經(jīng)退行性疾病,包括阿爾茨海默病(AD)和帕金森病(PD)是由遺傳和環(huán)境因素共同引起的高度衰弱的疾病。探索這些疾病的神經(jīng)基礎(chǔ)以及人體如何典型地預(yù)防神經(jīng)變性的研究可以幫助設(shè)計更有效的治療和預(yù)防策略。
蘇黎世大學(xué)和卡羅林斯卡大學(xué)索爾納醫(yī)院的研究人員在小鼠身上進行了一項研究,旨在更好地了解NG2神經(jīng)膠質(zhì)細胞(中樞神經(jīng)系統(tǒng)中的一類神經(jīng)膠質(zhì)細胞)在朊病毒誘導(dǎo)的神經(jīng)變性中的作用。朊病毒疾病是一種神經(jīng)退行性疾病,其神經(jīng)毒性是由一種叫做朊病毒的蛋白質(zhì)的異常積聚引起的。
研究人員發(fā)表在《Nature Neuroscience》雜志上的研究結(jié)果表明,NG2膠質(zhì)細胞可以防止與朊病毒積累有關(guān)的神經(jīng)毒性和神經(jīng)變性。此外,他們還深入了解了這些細胞減輕神經(jīng)變性的機制。

圖1 NLRC5感知NAD+損耗形成泛視小體并驅(qū)動泛視癥和炎癥
“我對NG2膠質(zhì)細胞的興趣可以追溯到許多年前,當時我正在研究中樞神經(jīng)系統(tǒng)炎癥的調(diào)節(jié)機制,”該論文的合著者Yingjun Liu告訴Medical Xpress。“我們知道,我們的免疫系統(tǒng)是我們身體抵御感染和疾病的關(guān)鍵衛(wèi)士。然而,它需要嚴格控制,因為過多的免疫反應(yīng)可能對正常組織有害。”
已知外周器官(即對環(huán)境變化作出反應(yīng)的身體部位)中的特殊細胞類型有助于在處理入侵病原體或受損組織后快速解決炎癥。
令人驚訝的是,神經(jīng)科學(xué)家還沒有在中樞神經(jīng)系統(tǒng)中發(fā)現(xiàn)類似的特化細胞,盡管有報道稱神經(jīng)元對神經(jīng)炎癥期間釋放的免疫介質(zhì)敏感。
“我的懷疑是NG2膠質(zhì)細胞可能作為這樣一種細胞類型,因為它們可以像中樞神經(jīng)系統(tǒng)中的經(jīng)典免疫細胞(如小膠質(zhì)細胞)一樣快速地對免疫刺激做出反應(yīng),但不釋放促進炎癥反應(yīng)的因子,”Liu說。“除此之外,早期的研究已經(jīng)觀察到受各種神經(jīng)系統(tǒng)疾病影響的患者大腦中NG2膠質(zhì)細胞可能發(fā)生變化。然而,它們?nèi)绾斡绊懠膊∵M展尚不清楚。”
識別保護中樞神經(jīng)系統(tǒng)免受神經(jīng)毒性的細胞并不能幫助理解特定神經(jīng)退行性疾病的基礎(chǔ)。盡管如此,它可以幫助設(shè)計新的治療干預(yù)措施來治愈或預(yù)防這些疾病。
“幾年前,我們開發(fā)了一種方法,可以有效地從培養(yǎng)的腦切片和動物模型的腦組織中消除NG2膠質(zhì)細胞,并發(fā)現(xiàn)NG2膠質(zhì)細胞確實在維持健康大腦中的穩(wěn)態(tài)小膠質(zhì)細胞狀態(tài)方面起著至關(guān)重要的作用,”Liu說。“在目前的研究中,在這些方法的幫助下,我們進一步研究了NG2膠質(zhì)細胞在病理條件下的作用,方法是在朊病毒疾病的背景下操縱它們,這是一組致命的腦部疾病,可以在幾個月內(nèi)殺死病人。”
Liu和他的同事最近的研究專門探討了NG2膠質(zhì)細胞在神經(jīng)退行性朊病毒疾病出現(xiàn)中的作用。朊病毒是自然界中發(fā)現(xiàn)的蛋白質(zhì),與大腦中大量存在的一些正常蛋白質(zhì)具有相同的氨基酸序列。這基本上意味著朊病毒和某些“正常”蛋白質(zhì)是由人類基因組中相同的DNA片段編碼的。
“然而,與正常的朊病毒相比,朊病毒在3D中折疊異常,并且有能力將正常的朊病毒轉(zhuǎn)化為病理形式,”Liu解釋說。“事實上,許多腦部疾病,包括阿爾茨海默病等非常常見的疾病,都是由類似的發(fā)病機制引起的。在我們的實驗中,我們用兩個實驗系統(tǒng)模擬了朊病毒疾病。”
在他們的第一個實驗裝置中,Liu和他的同事將在孵化器中保持“活”的大腦切片暴露于朊病毒。幾周內(nèi),朊病毒引起的病理變化與提取這些培養(yǎng)物的患者大腦中觀察到的變化相似。
“這個系統(tǒng)使我們能夠快速測試科學(xué)假設(shè)和潛在的治療方法,”Liu說。

圖2 朊病毒疾病模型中NG2膠質(zhì)細胞的激活
在他們的第二個實驗中,研究人員將小鼠暴露于朊病毒中,誘發(fā)了一種模仿人類朊病毒疾病的“疾病”,具有類似的疾病軌跡。這使他們能夠測試他們的假設(shè),并評估與人類有共同之處的活體哺乳動物的潛在治療方法。
Liu說:“我們從兩個模型系統(tǒng)(即大腦切片和小鼠)中消除了NG2膠質(zhì)細胞,并將它們與具有完整NG2膠質(zhì)細胞的模型系統(tǒng)進行了比較,以了解疾病相關(guān)過程的演變。我們發(fā)現(xiàn),當缺乏NG2膠質(zhì)細胞時,疾病過程,特別是暴露于朊病毒后神經(jīng)元的死亡會加速,這表明這些細胞正在保護我們免受疾病的侵害。”
Liu和他的同事們還進行了分析,以進一步驗證他們的發(fā)現(xiàn),特別是從組織和小鼠中去除NG2膠質(zhì)細胞。他們發(fā)現(xiàn),這些細胞的移除增強了小膠質(zhì)細胞(大腦中的免疫細胞)的生物學(xué)過程,該過程負責產(chǎn)生一種稱為前列腺素E2的脂質(zhì)分子。
Liu說:“至關(guān)重要的是,之前的研究發(fā)現(xiàn),前列腺素E2水平在朊病毒疾病患者的大腦中更高,盡管前列腺素E2水平升高與疾病進展的相關(guān)性尚不清楚。因此,我們下一步研究了朊病毒疾病模型中NG2膠質(zhì)細胞消除后前列腺素E2產(chǎn)生的增強如何與神經(jīng)元死亡的增強有關(guān)。”
值得注意的是,研究人員觀察到脂質(zhì)分子前列腺素E2可以與神經(jīng)元表面的一種叫做EP4的蛋白質(zhì)結(jié)合。這引發(fā)了一個有毒的信號傳導(dǎo)過程,最終殺死了神經(jīng)元,破壞了大腦的正常功能。
“首先,我們發(fā)現(xiàn)朊病毒疾病中的NG2膠質(zhì)細胞具有神經(jīng)保護作用,”Liu說。“然后我們還發(fā)現(xiàn)NG2膠質(zhì)細胞作為小膠質(zhì)細胞中前列腺素E2生物合成的抑制因子。第三,我們發(fā)現(xiàn)大腦中過量的前列腺素E2通過與神經(jīng)元表面的EP4受體結(jié)合,增強了朊病毒對神經(jīng)元的殺傷作用。”
總的來說,該研究小組收集的結(jié)果強調(diào)了NG2膠質(zhì)細胞對朊病毒誘導(dǎo)的神經(jīng)變性的保護作用,因為這些細胞被發(fā)現(xiàn)可以抑制前列腺素E2的毒性作用。在未來,他們的工作可能有助于開發(fā)針對朊病毒疾病和其他類似形式的神經(jīng)退行性疾病的新療法。
Liu補充說:“一個有趣但仍未解決的問題是,我們?nèi)绾螌⒛壳把芯康陌l(fā)現(xiàn)轉(zhuǎn)化為最終可能對患者有幫助的東西,例如,通過增強疾病期間大腦中NG2膠質(zhì)細胞的有益作用。這將依賴于未來對疾病發(fā)病過程中控制有益NG2膠質(zhì)細胞反應(yīng)的分子機制的深入研究。”
參考資料
[1] NG2 glia protect against prion neurotoxicity by inhibiting microglia-to-neuron prostaglandin E2 signaling



