摘要:每一個CRISPR反應(yīng)的核心,都是通過引導(dǎo)RNA到DNA上的目標位點的Cas蛋白質(zhì)的強分子連接。
每一個CRISPR反應(yīng)的核心,無論是自然發(fā)生在細菌中,還是通過CRIPSR-Cas基因編輯技術(shù)加以利用,都是通過引導(dǎo)RNA到達DNA上的目標位點,使Cas蛋白質(zhì)形成一個強大的分子鍵。
霍華德·休斯醫(yī)學(xué)研究所研究員Michelle Wang說:“在穩(wěn)定的邊界和在正確的時間脫離之間有一個平衡。”“我們真正想要的是調(diào)節(jié)結(jié)合力的能力。這給了我們微調(diào)基因編輯潛力的可能性。”
Wang實驗室的博士生、該論文的主要作者Porter Hall認為,Cas蛋白的結(jié)合不能太短暫。如果它不能穩(wěn)定地結(jié)合DNA的目標區(qū)域,精確的基因編輯可能不會有效,可能會導(dǎo)致脫靶效應(yīng)。“但如果蛋白質(zhì)永遠停留在那里,那么基因編輯過程就無法完成,”Hall說。

圖1 RNA聚合酶如何可以不進行切割就識別DNA序列就去除一個結(jié)合的dCas 圖源:[1])
通過對Cas與DNA結(jié)合的精確分子水平機制的研究,Wang和他的同事們首次解釋了運動蛋白(RNA聚合酶)如何去除一個結(jié)合的dCas(一種經(jīng)過工程改造的Cas),可以不進行切割就識別DNA序列。
這一見解揭示了如何調(diào)整Cas去除,有助于未來的CRISPR應(yīng)用。
研究人員寫道:“要充分發(fā)揮CRISPR技術(shù)的潛力,對Cas結(jié)合穩(wěn)定性的深入機制理解至關(guān)重要。”“這項工作強調(diào)了R-loop在dCas結(jié)合穩(wěn)定性中的重要性,并為CRISPR技術(shù)的廣泛應(yīng)用提供了有價值的機制見解。”
Wang實驗室研究馬達蛋白如何沿著DNA鏈移動,執(zhí)行重要的生物過程。
Wang說,馬達蛋白RNA聚合酶在執(zhí)行基因表達功能時,會對“路障”施加壓力,將DNA復(fù)制到RNA。在本研究中,這個路障就是內(nèi)切酶缺陷Cas (dCas)。
此前,研究人員使用納米光子鑷子機械地分離了兩條DNA鏈,繪制出結(jié)合的dCas蛋白質(zhì)在DNA上的位置。他們稱之為DNA unzipping mapper。
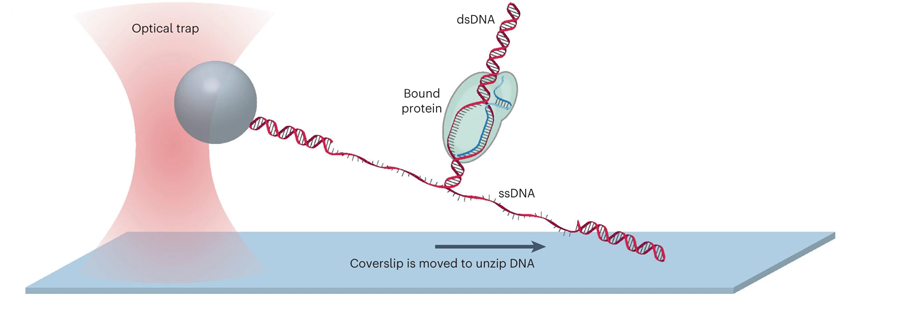
圖2 使用DNA解壓縮映射器繪制dCas與DNA相互作用的高分辨率圖 (圖源:[1])
先前的研究表明,馬達蛋白只可能從一側(cè)(極性)去除dCas。使用當(dāng)前研究的DNA unzipping mapper,康奈爾大學(xué)的研究人員發(fā)現(xiàn)了其中的原因:因為RNA聚合酶只能從一側(cè)折疊結(jié)合dCas的引導(dǎo)RNA和目標DNA之間形成的環(huán)(稱為 "R-loop"),即距離PAM(protospacer adjacent motif)遠的一側(cè)(或遠處),PAM是一個2-6個堿基對長的短DNA序列,緊隨裂解目標DNA區(qū)域。
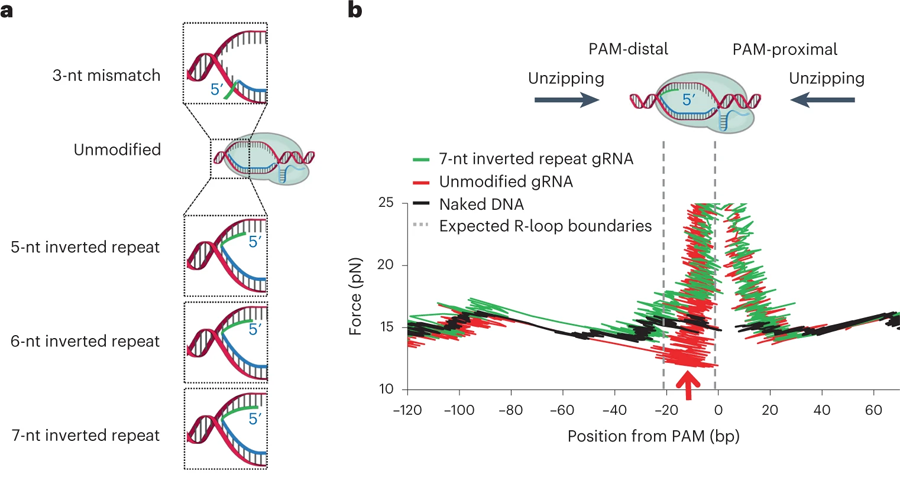
圖3 結(jié)合dCas復(fù)合物的轉(zhuǎn)錄讀取的定量測定(圖源:[1])
研究人員描述了該機制是如何工作的,他們也展示了如何通過修改引導(dǎo)RNA來調(diào)整dCas R-loop的穩(wěn)定性。
“我們希望Cas蛋白質(zhì)如何工作的基礎(chǔ)知識最終能導(dǎo)致更有效的基因編輯和更廣泛的CRISPR技術(shù)應(yīng)用,”Wang說。
參考資料:
[1] Polarity of the CRISPR Roadblock to Transcription
摘要:每一個CRISPR反應(yīng)的核心,都是通過引導(dǎo)RNA到DNA上的目標位點的Cas蛋白質(zhì)的強分子連接。
每一個CRISPR反應(yīng)的核心,無論是自然發(fā)生在細菌中,還是通過CRIPSR-Cas基因編輯技術(shù)加以利用,都是通過引導(dǎo)RNA到達DNA上的目標位點,使Cas蛋白質(zhì)形成一個強大的分子鍵。
霍華德·休斯醫(yī)學(xué)研究所研究員Michelle Wang說:“在穩(wěn)定的邊界和在正確的時間脫離之間有一個平衡。”“我們真正想要的是調(diào)節(jié)結(jié)合力的能力。這給了我們微調(diào)基因編輯潛力的可能性。”
Wang實驗室的博士生、該論文的主要作者Porter Hall認為,Cas蛋白的結(jié)合不能太短暫。如果它不能穩(wěn)定地結(jié)合DNA的目標區(qū)域,精確的基因編輯可能不會有效,可能會導(dǎo)致脫靶效應(yīng)。“但如果蛋白質(zhì)永遠停留在那里,那么基因編輯過程就無法完成,”Hall說。

圖1 RNA聚合酶如何可以不進行切割就識別DNA序列就去除一個結(jié)合的dCas 圖源:[1])
通過對Cas與DNA結(jié)合的精確分子水平機制的研究,Wang和他的同事們首次解釋了運動蛋白(RNA聚合酶)如何去除一個結(jié)合的dCas(一種經(jīng)過工程改造的Cas),可以不進行切割就識別DNA序列。
這一見解揭示了如何調(diào)整Cas去除,有助于未來的CRISPR應(yīng)用。
研究人員寫道:“要充分發(fā)揮CRISPR技術(shù)的潛力,對Cas結(jié)合穩(wěn)定性的深入機制理解至關(guān)重要。”“這項工作強調(diào)了R-loop在dCas結(jié)合穩(wěn)定性中的重要性,并為CRISPR技術(shù)的廣泛應(yīng)用提供了有價值的機制見解。”
Wang實驗室研究馬達蛋白如何沿著DNA鏈移動,執(zhí)行重要的生物過程。
Wang說,馬達蛋白RNA聚合酶在執(zhí)行基因表達功能時,會對“路障”施加壓力,將DNA復(fù)制到RNA。在本研究中,這個路障就是內(nèi)切酶缺陷Cas (dCas)。
此前,研究人員使用納米光子鑷子機械地分離了兩條DNA鏈,繪制出結(jié)合的dCas蛋白質(zhì)在DNA上的位置。他們稱之為DNA unzipping mapper。

圖2 使用DNA解壓縮映射器繪制dCas與DNA相互作用的高分辨率圖 (圖源:[1])
先前的研究表明,馬達蛋白只可能從一側(cè)(極性)去除dCas。使用當(dāng)前研究的DNA unzipping mapper,康奈爾大學(xué)的研究人員發(fā)現(xiàn)了其中的原因:因為RNA聚合酶只能從一側(cè)折疊結(jié)合dCas的引導(dǎo)RNA和目標DNA之間形成的環(huán)(稱為 "R-loop"),即距離PAM(protospacer adjacent motif)遠的一側(cè)(或遠處),PAM是一個2-6個堿基對長的短DNA序列,緊隨裂解目標DNA區(qū)域。

圖3 結(jié)合dCas復(fù)合物的轉(zhuǎn)錄讀取的定量測定(圖源:[1])
研究人員描述了該機制是如何工作的,他們也展示了如何通過修改引導(dǎo)RNA來調(diào)整dCas R-loop的穩(wěn)定性。
“我們希望Cas蛋白質(zhì)如何工作的基礎(chǔ)知識最終能導(dǎo)致更有效的基因編輯和更廣泛的CRISPR技術(shù)應(yīng)用,”Wang說。
參考資料:
[1] Polarity of the CRISPR Roadblock to Transcription



