摘要:倫敦大學(xué)學(xué)院的科學(xué)家們在人類細(xì)胞和小鼠身上進行的一項新研究發(fā)現(xiàn),免疫系統(tǒng)關(guān)鍵部分細(xì)胞中的一個缺陷可以用一種開創(chuàng)性的基因編輯技術(shù)修復(fù)。
倫敦大學(xué)學(xué)院的科學(xué)家們在人類細(xì)胞和小鼠身上進行的一項新研究發(fā)現(xiàn),免疫系統(tǒng)關(guān)鍵部分細(xì)胞中的一個缺陷可以用一種開創(chuàng)性的基因編輯技術(shù)修復(fù)。
研究人員說,這項發(fā)表在《科學(xué)轉(zhuǎn)化醫(yī)學(xué)》上的研究,可能會為一種罕見疾病的白細(xì)胞帶來新的治療方法,這種疾病通常幫助控制免疫系統(tǒng)的白細(xì)胞被稱為調(diào)節(jié)性T細(xì)胞,而保護身體免受重復(fù)感染和癌癥的白細(xì)胞被稱為效應(yīng)T細(xì)胞。

圖1 新研究發(fā)現(xiàn)用基因編輯技術(shù)修復(fù)免疫細(xì)胞的缺陷
CTLA-4功能不全的患者攜帶一種基因突變,導(dǎo)致這些T細(xì)胞功能異常。這導(dǎo)致他們遭受嚴(yán)重的自身免疫,他們的免疫系統(tǒng)攻擊自己的組織和器官,包括他們的血細(xì)胞。
這種情況還會阻礙他們的免疫系統(tǒng)的“記憶”,這意味著患者可能難以抵御相同病毒和細(xì)菌的復(fù)發(fā)感染。在某些情況下,它還會導(dǎo)致淋巴瘤,這是一種血癌。
在人類細(xì)胞中,使用“剪切”和“粘貼”基因編輯技術(shù),使用CRISPR/Cas系統(tǒng),研究人員能夠定位從CTLA-4不足患者身上提取的T細(xì)胞中的錯誤基因,并修復(fù)錯誤。這使細(xì)胞中的CTLA-4水平恢復(fù)到健康T細(xì)胞中的水平。他們還能夠通過給CTLA-4不足的小鼠注射基因編輯(校正)T細(xì)胞來改善疾病的癥狀。
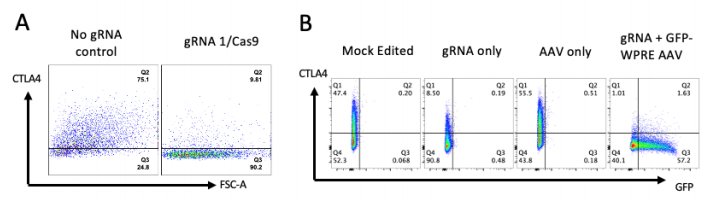
圖2 編輯CTLA-4基因和校正位點突變
聯(lián)合資深作者、倫敦大學(xué)學(xué)院大奧蒙德街兒童健康研究所基因治療和兒童免疫學(xué)馬赫布比安教授克萊爾·布斯說:“想到將這種療法應(yīng)用到患者身上,真的很令人興奮。如果我們能改善他們的癥狀,降低他們患淋巴增生性疾病的風(fēng)險,這將是向前邁出的一大步。這篇特別的論文很重要,因為我們正在使用最新的基因編輯技術(shù)來精確糾正這些T細(xì)胞,這是解決先天免疫錯誤的一種新方法。”
CTLA-4是T細(xì)胞產(chǎn)生的一種蛋白質(zhì),有助于控制免疫系統(tǒng)的活性。大多數(shù)人都攜帶兩個負(fù)責(zé)產(chǎn)生CTLA-4的有效基因拷貝,但那些只有一個功能拷貝的人產(chǎn)生的這種蛋白質(zhì)太少,不足以充分調(diào)節(jié)免疫系統(tǒng)。
目前,CTLA-4不足的標(biāo)準(zhǔn)治療方法是骨髓移植,以取代負(fù)責(zé)產(chǎn)生T細(xì)胞的干細(xì)胞。但移植是有風(fēng)險的,需要大劑量的化療和住院數(shù)周。CTLA-4功能不全的老年患者通常不能耐受移植手術(shù)。
布斯教授說:“我們的方法有很多積極的方面。通過糾正病人的T細(xì)胞,我們認(rèn)為它可以改善疾病的許多癥狀,同時比骨髓移植的毒性小得多。收集T細(xì)胞更容易,糾正T細(xì)胞也更容易。通過這種方法,患者在醫(yī)院的時間將會大大減少?!?/div>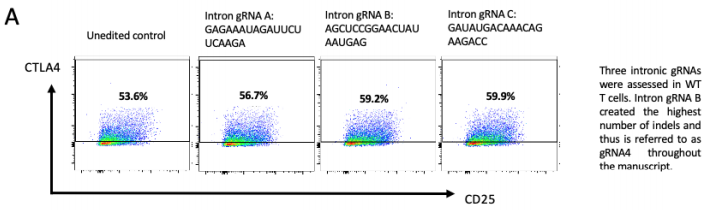
圖3 FACs圖示三種不同gRNA靶向基因內(nèi)區(qū)經(jīng)核轉(zhuǎn)染后代表性的正常CTLA-4表面表達
這種基因編輯方法是由倫敦大學(xué)學(xué)院的研究人員開發(fā)的,它使用了獲得過諾貝爾獎的基因編輯技術(shù)CRISPR/Cas9來定位并剪斷有缺陷的CTLA-4基因。然后用改良過的病毒將修正過的DNA序列傳送到細(xì)胞中。然后用一種被稱為同源定向修復(fù)的細(xì)胞DNA修復(fù)機制將其粘貼到基因的錯誤部分。

圖3 FACs圖示三種不同gRNA靶向基因內(nèi)區(qū)經(jīng)核轉(zhuǎn)染后代表性的正常CTLA-4表面表達
這使得研究人員能夠保存CTLA-4基因中的重要序列——即內(nèi)含子——使其僅在需要時被細(xì)胞打開或關(guān)閉。
聯(lián)合資深作者、臨床細(xì)胞和基因療法教授、倫敦大學(xué)學(xué)院感染和免疫學(xué)部主任艾瑪·莫里斯教授說:“在控制免疫反應(yīng)中起關(guān)鍵作用的基因并不是一直處于激活狀態(tài),而是受到非常嚴(yán)格的調(diào)控?!蔽覀兪褂玫募夹g(shù)允許我們保持控制基因表達的自然(內(nèi)源性)機制的完整性,同時糾正基因本身的錯誤。”
該研究由倫敦大學(xué)學(xué)院維康信托基金臨床博士托馬斯·??怂共┦款I(lǐng)導(dǎo),建立在馬薩諸塞州波士頓Dana-Farber/波士頓兒童癌癥和血液疾病中心的Pietro Genovese博士的工作基礎(chǔ)上,他是該研究的作者之一。
盡管CTLA-4不足的情況很罕見,但研究團隊表示,他們?yōu)橹委熯@種疾病開發(fā)的基因編輯療法可能是他們的方法的原理證明,這種方法可以用于治療其他疾病。
莫里斯教授補充說:“這是一種糾正基因突變的方法,可能適用于其他疾病。更重要的是,它讓我們能夠糾正調(diào)控異常或過度活躍的基因,也讓我們更多地了解基因表達和基因調(diào)控。”
參考資料:
[1] Therapeutic gene editing of T cells to correct CTLA-4 insufficiency
摘要:倫敦大學(xué)學(xué)院的科學(xué)家們在人類細(xì)胞和小鼠身上進行的一項新研究發(fā)現(xiàn),免疫系統(tǒng)關(guān)鍵部分細(xì)胞中的一個缺陷可以用一種開創(chuàng)性的基因編輯技術(shù)修復(fù)。
倫敦大學(xué)學(xué)院的科學(xué)家們在人類細(xì)胞和小鼠身上進行的一項新研究發(fā)現(xiàn),免疫系統(tǒng)關(guān)鍵部分細(xì)胞中的一個缺陷可以用一種開創(chuàng)性的基因編輯技術(shù)修復(fù)。
研究人員說,這項發(fā)表在《科學(xué)轉(zhuǎn)化醫(yī)學(xué)》上的研究,可能會為一種罕見疾病的白細(xì)胞帶來新的治療方法,這種疾病通常幫助控制免疫系統(tǒng)的白細(xì)胞被稱為調(diào)節(jié)性T細(xì)胞,而保護身體免受重復(fù)感染和癌癥的白細(xì)胞被稱為效應(yīng)T細(xì)胞。

圖1 新研究發(fā)現(xiàn)用基因編輯技術(shù)修復(fù)免疫細(xì)胞的缺陷
CTLA-4功能不全的患者攜帶一種基因突變,導(dǎo)致這些T細(xì)胞功能異常。這導(dǎo)致他們遭受嚴(yán)重的自身免疫,他們的免疫系統(tǒng)攻擊自己的組織和器官,包括他們的血細(xì)胞。
這種情況還會阻礙他們的免疫系統(tǒng)的“記憶”,這意味著患者可能難以抵御相同病毒和細(xì)菌的復(fù)發(fā)感染。在某些情況下,它還會導(dǎo)致淋巴瘤,這是一種血癌。
在人類細(xì)胞中,使用“剪切”和“粘貼”基因編輯技術(shù),使用CRISPR/Cas系統(tǒng),研究人員能夠定位從CTLA-4不足患者身上提取的T細(xì)胞中的錯誤基因,并修復(fù)錯誤。這使細(xì)胞中的CTLA-4水平恢復(fù)到健康T細(xì)胞中的水平。他們還能夠通過給CTLA-4不足的小鼠注射基因編輯(校正)T細(xì)胞來改善疾病的癥狀。

圖2 編輯CTLA-4基因和校正位點突變
聯(lián)合資深作者、倫敦大學(xué)學(xué)院大奧蒙德街兒童健康研究所基因治療和兒童免疫學(xué)馬赫布比安教授克萊爾·布斯說:“想到將這種療法應(yīng)用到患者身上,真的很令人興奮。如果我們能改善他們的癥狀,降低他們患淋巴增生性疾病的風(fēng)險,這將是向前邁出的一大步。這篇特別的論文很重要,因為我們正在使用最新的基因編輯技術(shù)來精確糾正這些T細(xì)胞,這是解決先天免疫錯誤的一種新方法?!?/div>
CTLA-4是T細(xì)胞產(chǎn)生的一種蛋白質(zhì),有助于控制免疫系統(tǒng)的活性。大多數(shù)人都攜帶兩個負(fù)責(zé)產(chǎn)生CTLA-4的有效基因拷貝,但那些只有一個功能拷貝的人產(chǎn)生的這種蛋白質(zhì)太少,不足以充分調(diào)節(jié)免疫系統(tǒng)。
目前,CTLA-4不足的標(biāo)準(zhǔn)治療方法是骨髓移植,以取代負(fù)責(zé)產(chǎn)生T細(xì)胞的干細(xì)胞。但移植是有風(fēng)險的,需要大劑量的化療和住院數(shù)周。CTLA-4功能不全的老年患者通常不能耐受移植手術(shù)。
布斯教授說:“我們的方法有很多積極的方面。通過糾正病人的T細(xì)胞,我們認(rèn)為它可以改善疾病的許多癥狀,同時比骨髓移植的毒性小得多。收集T細(xì)胞更容易,糾正T細(xì)胞也更容易。通過這種方法,患者在醫(yī)院的時間將會大大減少?!?/div>
圖3 FACs圖示三種不同gRNA靶向基因內(nèi)區(qū)經(jīng)核轉(zhuǎn)染后代表性的正常CTLA-4表面表達
這種基因編輯方法是由倫敦大學(xué)學(xué)院的研究人員開發(fā)的,它使用了獲得過諾貝爾獎的基因編輯技術(shù)CRISPR/Cas9來定位并剪斷有缺陷的CTLA-4基因。然后用改良過的病毒將修正過的DNA序列傳送到細(xì)胞中。然后用一種被稱為同源定向修復(fù)的細(xì)胞DNA修復(fù)機制將其粘貼到基因的錯誤部分。

圖3 FACs圖示三種不同gRNA靶向基因內(nèi)區(qū)經(jīng)核轉(zhuǎn)染后代表性的正常CTLA-4表面表達
這使得研究人員能夠保存CTLA-4基因中的重要序列——即內(nèi)含子——使其僅在需要時被細(xì)胞打開或關(guān)閉。
聯(lián)合資深作者、臨床細(xì)胞和基因療法教授、倫敦大學(xué)學(xué)院感染和免疫學(xué)部主任艾瑪·莫里斯教授說:“在控制免疫反應(yīng)中起關(guān)鍵作用的基因并不是一直處于激活狀態(tài),而是受到非常嚴(yán)格的調(diào)控?!蔽覀兪褂玫募夹g(shù)允許我們保持控制基因表達的自然(內(nèi)源性)機制的完整性,同時糾正基因本身的錯誤?!?/div>
該研究由倫敦大學(xué)學(xué)院維康信托基金臨床博士托馬斯·??怂共┦款I(lǐng)導(dǎo),建立在馬薩諸塞州波士頓Dana-Farber/波士頓兒童癌癥和血液疾病中心的Pietro Genovese博士的工作基礎(chǔ)上,他是該研究的作者之一。
盡管CTLA-4不足的情況很罕見,但研究團隊表示,他們?yōu)橹委熯@種疾病開發(fā)的基因編輯療法可能是他們的方法的原理證明,這種方法可以用于治療其他疾病。
莫里斯教授補充說:“這是一種糾正基因突變的方法,可能適用于其他疾病。更重要的是,它讓我們能夠糾正調(diào)控異?;蜻^度活躍的基因,也讓我們更多地了解基因表達和基因調(diào)控。”
參考資料:
[1] Therapeutic gene editing of T cells to correct CTLA-4 insufficiency



