摘要:通過化學(xué)設(shè)計(jì)和合成,科學(xué)家們將獲得諾貝爾獎(jiǎng)的技術(shù)與治療技術(shù)結(jié)合在一起,克服了CRISPR的一個(gè)關(guān)鍵限制。具體來說,這項(xiàng)突破性的工作提供了一種系統(tǒng),可以為生成名為CRISPR-Cas9的基因編輯機(jī)器提供所需的數(shù)據(jù)。
美國西北大學(xué)的一組研究人員設(shè)計(jì)了一種新的基因編輯平臺(tái),它可以為未來基于crispr的近乎無限的治療方法的應(yīng)用提供信息。
通過化學(xué)設(shè)計(jì)和合成,該團(tuán)隊(duì)將獲得諾貝爾獎(jiǎng)的技術(shù)與他們自己實(shí)驗(yàn)室誕生的治療技術(shù)結(jié)合在一起,克服了CRISPR的一個(gè)關(guān)鍵限制。具體來說,這項(xiàng)突破性的工作提供了一種系統(tǒng),可以為生成名為CRISPR-Cas9的基因編輯機(jī)器提供所需的數(shù)據(jù)。該團(tuán)隊(duì)開發(fā)了一種將Cas-9蛋白轉(zhuǎn)化為球形核酸(SNA)的方法,并將所需的關(guān)鍵成分裝入其中,以訪問廣泛的組織和細(xì)胞類型,以及基因編輯所需的細(xì)胞內(nèi)分隔室。
這項(xiàng)研究發(fā)表在《美國化學(xué)學(xué)會(huì)雜志》上的一篇題為“CRISPR Spherical Nucleic Acids”的論文中,展示了CRISPR SNAs如何在保持生物活性和基因編輯能力的同時(shí)穿過細(xì)胞膜進(jìn)入細(xì)胞核。
圖1 將Cas-9蛋白轉(zhuǎn)化為球形核酸(SNA)的方法(圖源:[1])
這項(xiàng)工作建立在由納米技術(shù)先驅(qū)Chad a . Mirkin領(lǐng)導(dǎo)的25年努力的基礎(chǔ)上,他發(fā)現(xiàn)了SNAs的特性,以及將它們與著名的線性表兄弟(生命藍(lán)圖)區(qū)別開來的因素。米爾金因發(fā)明了SNAs而聞名,這種結(jié)構(gòu)通常由密集覆蓋著DNA或RNA的球形納米顆粒組成,賦予它們與自然界中發(fā)現(xiàn)的核酸形式截然不同的化學(xué)和物理特性。
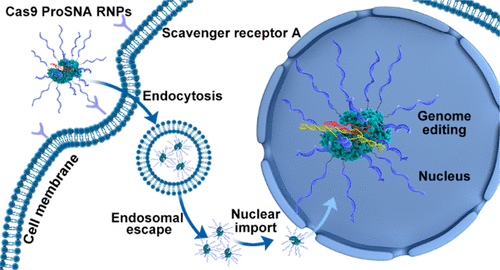
圖2 Cas9 ProSNA RNPs(圖源:[1])
米爾金是西北大學(xué)溫伯格文理學(xué)院的喬治·b·拉斯曼化學(xué)教授,也是國際納米技術(shù)研究所的主任。米爾金還是麥考密克工程學(xué)院化學(xué)與生物工程、生物醫(yī)學(xué)工程和材料科學(xué)與工程的教授,也是西北大學(xué)范伯格醫(yī)學(xué)院的醫(yī)學(xué)教授。
SNAs有許多種類,其核心和外殼的化學(xué)成分和大小不同。目前,SNAs正在六項(xiàng)人類臨床試驗(yàn)中被評(píng)估為有效的治療藥物,其中包括治療多形膠質(zhì)母細(xì)胞瘤(腦癌)和多種皮膚癌等衰弱疾病的試驗(yàn)。
Mirkin說:“這些新穎的納米結(jié)構(gòu)為研究人員提供了一條途徑,通過大幅增加CRISPR機(jī)器可以傳遞到的細(xì)胞和組織類型,來拓寬CRISPR的用途范圍。”“我們已經(jīng)知道sna提供了進(jìn)入皮膚、大腦、眼睛、免疫系統(tǒng)、胃腸道、心臟和肺的特權(quán)。當(dāng)這種途徑與過去四分之一世紀(jì)生物醫(yī)學(xué)最重要的創(chuàng)新之一相結(jié)合時(shí),好事就會(huì)隨之而來?!?/div>
圖3 基因工程Cas9蛋白GALA內(nèi)切酶N-端肽結(jié)合的方案設(shè)計(jì)(圖源:[1])
在目前的研究中,Mirkin的團(tuán)隊(duì)使用了基因編輯所需的Cas9蛋白質(zhì)作為結(jié)構(gòu)的核心,并將DNA鏈附著在其表面,從而制造出一種新型SNA。此外,這些SNAs預(yù)先裝載了能夠進(jìn)行基因編輯的RNA,并與多肽融合,以控制它們?cè)诩?xì)胞隔層屏障中導(dǎo)航的能力,從而最大化效率。這些SNAs,像其他種類的SNAs一樣,在不使用轉(zhuǎn)染劑(通常需要將遺傳物質(zhì)傳遞到細(xì)胞中)的情況下有效地進(jìn)入細(xì)胞,并在一些人類和小鼠細(xì)胞系中表現(xiàn)出高達(dá)32% - 47%的基因編輯效率。

圖3 基因工程Cas9蛋白GALA內(nèi)切酶N-端肽結(jié)合的方案設(shè)計(jì)(圖源:[1])
該研究團(tuán)隊(duì)包括研究生研究員黃馳、韓振宇(Henry)和Michael Evangelopoulos。他們的研究得到了美國國立衛(wèi)生研究院國家癌癥研究所、謝爾曼·費(fèi)爾柴爾德基金會(huì)、約翰·n·尼克爾森博士獎(jiǎng)學(xué)金和亞歷山大·s·奧納西斯公益基金會(huì)的支持。
參考資料:
[1] Chi Huang, Zhenyu Han, Michael Evangelopoulos, Chad A. Mirkin. CRISPR Spherical Nucleic Acids. Journal of the American Chemical Society, 2022; DOI: 10.1021/jacs.2c07913
摘要:通過化學(xué)設(shè)計(jì)和合成,科學(xué)家們將獲得諾貝爾獎(jiǎng)的技術(shù)與治療技術(shù)結(jié)合在一起,克服了CRISPR的一個(gè)關(guān)鍵限制。具體來說,這項(xiàng)突破性的工作提供了一種系統(tǒng),可以為生成名為CRISPR-Cas9的基因編輯機(jī)器提供所需的數(shù)據(jù)。
美國西北大學(xué)的一組研究人員設(shè)計(jì)了一種新的基因編輯平臺(tái),它可以為未來基于crispr的近乎無限的治療方法的應(yīng)用提供信息。
通過化學(xué)設(shè)計(jì)和合成,該團(tuán)隊(duì)將獲得諾貝爾獎(jiǎng)的技術(shù)與他們自己實(shí)驗(yàn)室誕生的治療技術(shù)結(jié)合在一起,克服了CRISPR的一個(gè)關(guān)鍵限制。具體來說,這項(xiàng)突破性的工作提供了一種系統(tǒng),可以為生成名為CRISPR-Cas9的基因編輯機(jī)器提供所需的數(shù)據(jù)。該團(tuán)隊(duì)開發(fā)了一種將Cas-9蛋白轉(zhuǎn)化為球形核酸(SNA)的方法,并將所需的關(guān)鍵成分裝入其中,以訪問廣泛的組織和細(xì)胞類型,以及基因編輯所需的細(xì)胞內(nèi)分隔室。
這項(xiàng)研究發(fā)表在《美國化學(xué)學(xué)會(huì)雜志》上的一篇題為“CRISPR Spherical Nucleic Acids”的論文中,展示了CRISPR SNAs如何在保持生物活性和基因編輯能力的同時(shí)穿過細(xì)胞膜進(jìn)入細(xì)胞核。

圖1 將Cas-9蛋白轉(zhuǎn)化為球形核酸(SNA)的方法(圖源:[1])
這項(xiàng)工作建立在由納米技術(shù)先驅(qū)Chad a . Mirkin領(lǐng)導(dǎo)的25年努力的基礎(chǔ)上,他發(fā)現(xiàn)了SNAs的特性,以及將它們與著名的線性表兄弟(生命藍(lán)圖)區(qū)別開來的因素。米爾金因發(fā)明了SNAs而聞名,這種結(jié)構(gòu)通常由密集覆蓋著DNA或RNA的球形納米顆粒組成,賦予它們與自然界中發(fā)現(xiàn)的核酸形式截然不同的化學(xué)和物理特性。

圖2 Cas9 ProSNA RNPs(圖源:[1])
米爾金是西北大學(xué)溫伯格文理學(xué)院的喬治·b·拉斯曼化學(xué)教授,也是國際納米技術(shù)研究所的主任。米爾金還是麥考密克工程學(xué)院化學(xué)與生物工程、生物醫(yī)學(xué)工程和材料科學(xué)與工程的教授,也是西北大學(xué)范伯格醫(yī)學(xué)院的醫(yī)學(xué)教授。
SNAs有許多種類,其核心和外殼的化學(xué)成分和大小不同。目前,SNAs正在六項(xiàng)人類臨床試驗(yàn)中被評(píng)估為有效的治療藥物,其中包括治療多形膠質(zhì)母細(xì)胞瘤(腦癌)和多種皮膚癌等衰弱疾病的試驗(yàn)。
Mirkin說:“這些新穎的納米結(jié)構(gòu)為研究人員提供了一條途徑,通過大幅增加CRISPR機(jī)器可以傳遞到的細(xì)胞和組織類型,來拓寬CRISPR的用途范圍?!薄拔覀円呀?jīng)知道sna提供了進(jìn)入皮膚、大腦、眼睛、免疫系統(tǒng)、胃腸道、心臟和肺的特權(quán)。當(dāng)這種途徑與過去四分之一世紀(jì)生物醫(yī)學(xué)最重要的創(chuàng)新之一相結(jié)合時(shí),好事就會(huì)隨之而來?!?/div>
圖3 基因工程Cas9蛋白GALA內(nèi)切酶N-端肽結(jié)合的方案設(shè)計(jì)(圖源:[1])
在目前的研究中,Mirkin的團(tuán)隊(duì)使用了基因編輯所需的Cas9蛋白質(zhì)作為結(jié)構(gòu)的核心,并將DNA鏈附著在其表面,從而制造出一種新型SNA。此外,這些SNAs預(yù)先裝載了能夠進(jìn)行基因編輯的RNA,并與多肽融合,以控制它們?cè)诩?xì)胞隔層屏障中導(dǎo)航的能力,從而最大化效率。這些SNAs,像其他種類的SNAs一樣,在不使用轉(zhuǎn)染劑(通常需要將遺傳物質(zhì)傳遞到細(xì)胞中)的情況下有效地進(jìn)入細(xì)胞,并在一些人類和小鼠細(xì)胞系中表現(xiàn)出高達(dá)32% - 47%的基因編輯效率。

圖3 基因工程Cas9蛋白GALA內(nèi)切酶N-端肽結(jié)合的方案設(shè)計(jì)(圖源:[1])
該研究團(tuán)隊(duì)包括研究生研究員黃馳、韓振宇(Henry)和Michael Evangelopoulos。他們的研究得到了美國國立衛(wèi)生研究院國家癌癥研究所、謝爾曼·費(fèi)爾柴爾德基金會(huì)、約翰·n·尼克爾森博士獎(jiǎng)學(xué)金和亞歷山大·s·奧納西斯公益基金會(huì)的支持。
參考資料:
[1] Chi Huang, Zhenyu Han, Michael Evangelopoulos, Chad A. Mirkin. CRISPR Spherical Nucleic Acids. Journal of the American Chemical Society, 2022; DOI: 10.1021/jacs.2c07913



