摘要:根據羅格斯大學的一項研究表明,人類內源性逆轉錄酶的晶體結構與HIV逆轉錄酶相似,HIV逆轉錄酶是一種眾所周知的易處理藥物靶標,它將有助于設計治療癌癥和其他疾病的藥物。
這項研究發表在《美國國家科學院院刊》(PNAS)上,描述了有史以來第一個內源性逆轉錄酶的高分辨率三維結構——特別是人類內源性逆轉錄病毒- k (HERV-K)逆轉錄酶(RT)。過去的研究發現,人類基因組的很大一部分是由過去病毒感染遺留下來的重復元素組成的,這些重復元素與包括癌癥在內的一系列嚴重疾病有關。
根據這項研究,該結構為RT抑制劑提供了治療機會——用于治療艾滋病毒感染或艾滋病的抗逆轉錄病毒藥物,以及用于癌癥、自身免疫和神經退行性疾病的乙肝藥物。
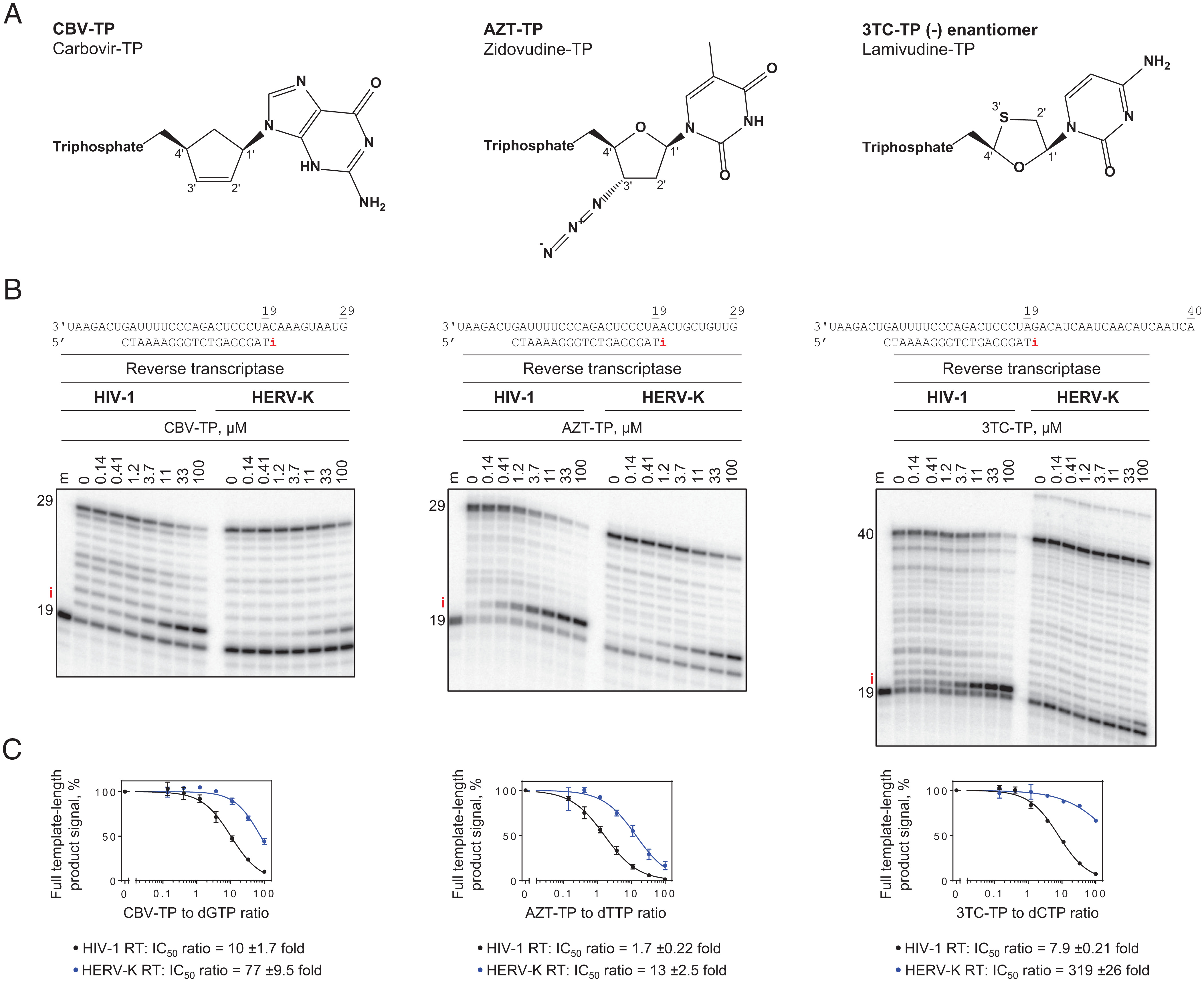
圖1 核苷酸類似物依賴性抑制HIV-1和HERV-K RTs的DNA聚合活性
羅格斯大學高級生物技術和醫學中心(CABM)的常駐教員、生物技術公司ROME Therapeutics的科學顧問委員會成員Eddy Arnold說:“這項研究標志著我們在了解內源性逆轉錄病毒以及它們如何靶向治療疾病方面邁出了重要的一步。”
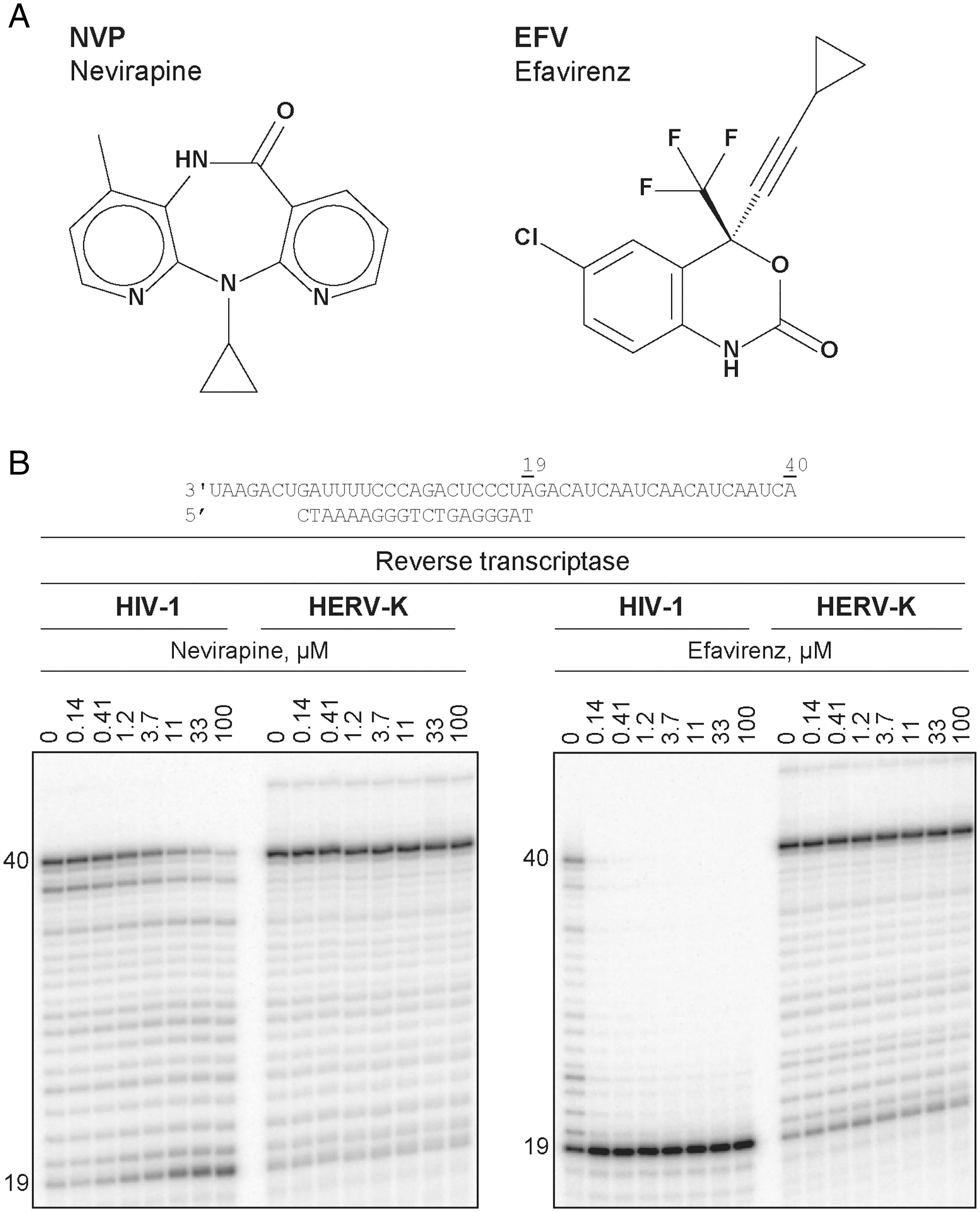
圖2 NVP和EFV依賴性抑制HIV-1和HERV-K RTs的DNA聚合活性
羅格斯大學杰出教授、化學和化學生物學理事會教授阿諾德說:“確定HIV RT的結構特征是設計對抗這種致命病毒的新藥物的一個關鍵轉折點。”“同樣,對人類內源性RT的更深入的研究可能會為癌癥和其他嚴重疾病的新療法鋪平道路。”
根據過去的研究,基因組中的重復元素,如HERV-K,經常在癌癥中過度表達,并引發生物病毒模仿反應,可以改變腫瘤的微環境。
這項研究由羅馬治療公司(ROME Therapeutics)的研究人員共同撰寫。該公司是一家生物技術公司,旨在通過研究黑暗基因組(Dark Genome)開發治療癌癥和自身免疫性疾病的新療法。黑暗基因組是一組巨大的未知遺傳物質,占人類基因組的60%以上。
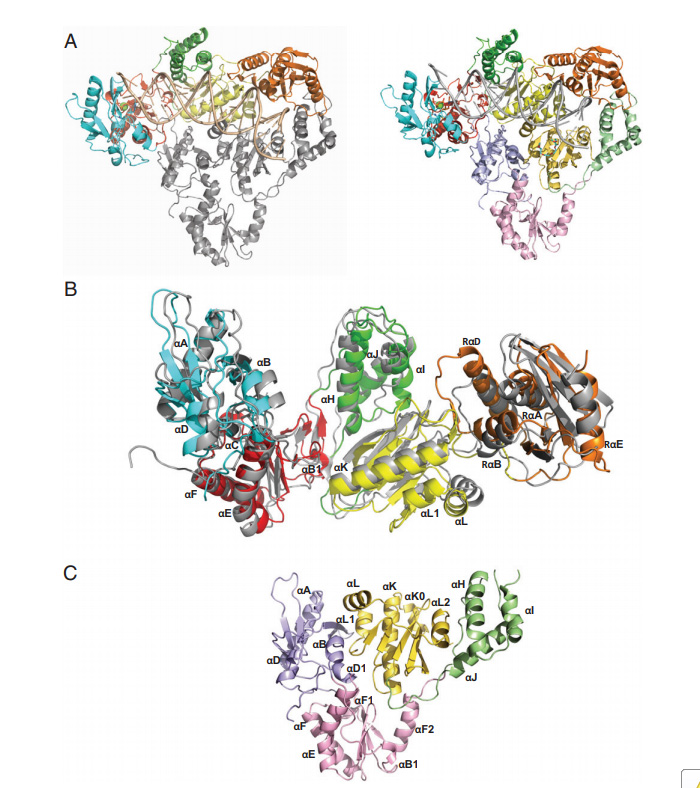
HERV-K RT結構概述
羅馬首席科學官Dennis Zaller說:“在這份報告中,我們描述了一種內源逆轉錄酶的晶體結構,一種被稱為HERV-K RT的逆轉錄酶,并表明它與HIV逆轉錄酶有顯著的相似之處,HIV逆轉錄酶是一種眾所周知的可控制的藥物靶標。”“這一成就是黑暗基因組領域的一個里程碑,為基于人類基因組中已建立的抗病毒靶點的基于結構的藥物設計提供了機會。這項工作是羅馬杰出的結構生物學團隊和世界領先的晶體學家合作的結果。”
參考資料:
[1] Eric T. Baldwin, Matthias Götte, Egor P. Tchesnokov, Eddy Arnold, Margit Hagel, Charles Nichols, Pam Dossang, Marieke Lamers, Paul Wan, Stefan Steinbacher, Donna L. Romero. Human endogenous retrovirus-K (HERV-K) reverse transcriptase (RT) structure and biochemistry reveals remarkable similarities to HIV-1 RT and opportunities for HERV-K–specific inhibition. Proceedings of the National Academy of Sciences, 2022; 119 (27) DOI: 10.1073/pnas.2200260119
摘要:根據羅格斯大學的一項研究表明,人類內源性逆轉錄酶的晶體結構與HIV逆轉錄酶相似,HIV逆轉錄酶是一種眾所周知的易處理藥物靶標,它將有助于設計治療癌癥和其他疾病的藥物。
這項研究發表在《美國國家科學院院刊》(PNAS)上,描述了有史以來第一個內源性逆轉錄酶的高分辨率三維結構——特別是人類內源性逆轉錄病毒- k (HERV-K)逆轉錄酶(RT)。過去的研究發現,人類基因組的很大一部分是由過去病毒感染遺留下來的重復元素組成的,這些重復元素與包括癌癥在內的一系列嚴重疾病有關。
根據這項研究,該結構為RT抑制劑提供了治療機會——用于治療艾滋病毒感染或艾滋病的抗逆轉錄病毒藥物,以及用于癌癥、自身免疫和神經退行性疾病的乙肝藥物。

圖1 核苷酸類似物依賴性抑制HIV-1和HERV-K RTs的DNA聚合活性
羅格斯大學高級生物技術和醫學中心(CABM)的常駐教員、生物技術公司ROME Therapeutics的科學顧問委員會成員Eddy Arnold說:“這項研究標志著我們在了解內源性逆轉錄病毒以及它們如何靶向治療疾病方面邁出了重要的一步。”

圖2 NVP和EFV依賴性抑制HIV-1和HERV-K RTs的DNA聚合活性
羅格斯大學杰出教授、化學和化學生物學理事會教授阿諾德說:“確定HIV RT的結構特征是設計對抗這種致命病毒的新藥物的一個關鍵轉折點。”“同樣,對人類內源性RT的更深入的研究可能會為癌癥和其他嚴重疾病的新療法鋪平道路。”
根據過去的研究,基因組中的重復元素,如HERV-K,經常在癌癥中過度表達,并引發生物病毒模仿反應,可以改變腫瘤的微環境。
這項研究由羅馬治療公司(ROME Therapeutics)的研究人員共同撰寫。該公司是一家生物技術公司,旨在通過研究黑暗基因組(Dark Genome)開發治療癌癥和自身免疫性疾病的新療法。黑暗基因組是一組巨大的未知遺傳物質,占人類基因組的60%以上。

HERV-K RT結構概述
羅馬首席科學官Dennis Zaller說:“在這份報告中,我們描述了一種內源逆轉錄酶的晶體結構,一種被稱為HERV-K RT的逆轉錄酶,并表明它與HIV逆轉錄酶有顯著的相似之處,HIV逆轉錄酶是一種眾所周知的可控制的藥物靶標。”“這一成就是黑暗基因組領域的一個里程碑,為基于人類基因組中已建立的抗病毒靶點的基于結構的藥物設計提供了機會。這項工作是羅馬杰出的結構生物學團隊和世界領先的晶體學家合作的結果。”
參考資料:
[1] Eric T. Baldwin, Matthias Götte, Egor P. Tchesnokov, Eddy Arnold, Margit Hagel, Charles Nichols, Pam Dossang, Marieke Lamers, Paul Wan, Stefan Steinbacher, Donna L. Romero. Human endogenous retrovirus-K (HERV-K) reverse transcriptase (RT) structure and biochemistry reveals remarkable similarities to HIV-1 RT and opportunities for HERV-K–specific inhibition. Proceedings of the National Academy of Sciences, 2022; 119 (27) DOI: 10.1073/pnas.2200260119



