摘要:本研究揭示了GLP-1RA司美格魯肽(semaglutide)通過體重依賴與非依賴的雙重機制改善代謝功能障礙相關脂肪性肝炎的組織學特征。
代謝因素與司美格魯肽的組織學療效
在2期臨床試驗中,每日0.4 mg司美格魯肽治療72周使59%的MASH患者實現脂肪性肝炎消退且纖維化無惡化,顯著優于安慰劑組(17%)。中介分析顯示,體重減輕介導了69.3%的MASH消退效應,但對纖維化改善的貢獻僅25.1%,提示存在獨立于減重的機制。代謝指標如糖化血紅蛋白(HbA1c)、空腹血糖(FPG)和胰島素抵抗(HOMA-IR)的改善與組織學緩解顯著相關。
司美格魯肽對肝臟脂肪變性的影響
基于SomaSignal蛋白質組學檢測,司美格魯肽呈劑量依賴性改善脂肪變性評分,0.4 mg組55%患者實現脂肪消退(安慰劑組9%)。其中前列腺素還原酶1(PTGR1)和β-葡萄糖醛酸酶(GUSB)的豐度顯著降低,二者與脂質代謝密切相關。

圖1 司美格魯肽在代謝功能障礙相關脂肪性肝炎中對代謝、炎癥和纖維化通路的調節作用
炎癥與肝細胞氣球樣變的調控
司美格魯肽顯著降低炎癥(82% vs 32%)和氣球樣變(80% vs 29%)的SomaSignal評分。關鍵蛋白如PTGR1、醛酮還原酶家族1成員B10(AKR1B10)和ADAMTS樣蛋白2(ADAMTSL2)的表達變化,提示其通過調節氧化應激和細胞外基質重塑發揮作用。
抗纖維化作用的雙重證據
盡管2期試驗未達到纖維化分期的顯著性終點,但SomaSignal檢測顯示0.4 mg組57%患者纖維化評分改善(安慰劑組16%)。動物實驗中,飲食誘導肥胖(DIO-MASH)和膽堿缺乏高脂飲食(CDA-HFD)模型均顯示司美格魯肽顯著降低膠原沉積(Picrosirius Red染色)和α平滑肌肌動蛋白(αSMA)表達。轉錄組分析發現,其下調Timp-1、MMP13等纖維化相關基因。
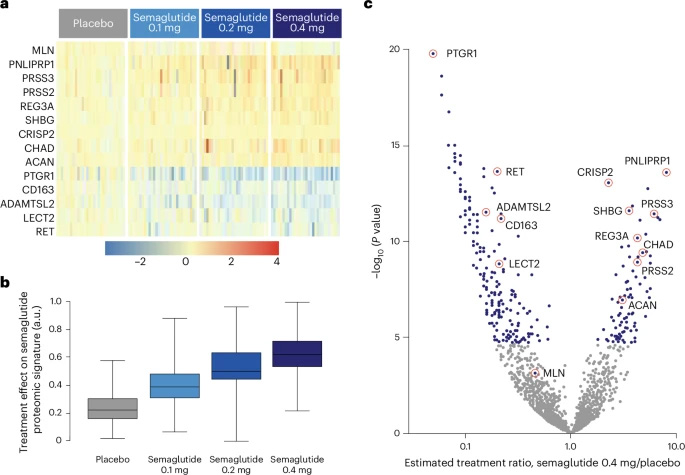
圖2 司美格魯肽治療效應對SomaScan適配體檢測平臺相關生物標志物的影響
循環蛋白質組的重塑
通過LASSO回歸篩選出的72種蛋白質構成“治療特征”,其中26種與體重變化無關。例如,血清蛋白酶抑制劑C1(SERPINC1)和載脂蛋白F(APOF)在MASH患者中低表達,經司美格魯肽治療后回升;而ADAMTSL2和氨基酸酰化酶1(ACY1)的過表達則被逆轉。獨立隊列驗證顯示,這些蛋白在健康人與MASH患者中存在差異表達,司美格魯肽使其趨向正常化。
機制探討與臨床意義
研究未在肝細胞、星狀細胞或庫普弗細胞中檢測到GLP-1受體表達,支持其通過外周代謝調控(如改善胰島素敏感性)和中樞抗炎通路間接作用。值得注意的是,ADAMTSL2和ACY1等蛋白同時與心血管疾病和肝細胞癌(HCC)風險相關,提示司美格魯肽可能具有多器官保護效應。
局限與展望
當前動物模型不能完全模擬人類MASH的復雜病理,且3期ESSENCE試驗的最終數據尚未公布。未來需進一步明確體重非依賴機制的具體靶點,并探索其對長期臨床結局(如肝硬化、HCC)的影響。
參考資料
[1] Modulation of metabolic, inflammatory and fibrotic pathways by semaglutide in metabolic dysfunction-associated steatohepatitis
摘要:本研究揭示了GLP-1RA司美格魯肽(semaglutide)通過體重依賴與非依賴的雙重機制改善代謝功能障礙相關脂肪性肝炎的組織學特征。
代謝因素與司美格魯肽的組織學療效
在2期臨床試驗中,每日0.4 mg司美格魯肽治療72周使59%的MASH患者實現脂肪性肝炎消退且纖維化無惡化,顯著優于安慰劑組(17%)。中介分析顯示,體重減輕介導了69.3%的MASH消退效應,但對纖維化改善的貢獻僅25.1%,提示存在獨立于減重的機制。代謝指標如糖化血紅蛋白(HbA1c)、空腹血糖(FPG)和胰島素抵抗(HOMA-IR)的改善與組織學緩解顯著相關。
司美格魯肽對肝臟脂肪變性的影響
基于SomaSignal蛋白質組學檢測,司美格魯肽呈劑量依賴性改善脂肪變性評分,0.4 mg組55%患者實現脂肪消退(安慰劑組9%)。其中前列腺素還原酶1(PTGR1)和β-葡萄糖醛酸酶(GUSB)的豐度顯著降低,二者與脂質代謝密切相關。

圖1 司美格魯肽在代謝功能障礙相關脂肪性肝炎中對代謝、炎癥和纖維化通路的調節作用
炎癥與肝細胞氣球樣變的調控
司美格魯肽顯著降低炎癥(82% vs 32%)和氣球樣變(80% vs 29%)的SomaSignal評分。關鍵蛋白如PTGR1、醛酮還原酶家族1成員B10(AKR1B10)和ADAMTS樣蛋白2(ADAMTSL2)的表達變化,提示其通過調節氧化應激和細胞外基質重塑發揮作用。
抗纖維化作用的雙重證據
盡管2期試驗未達到纖維化分期的顯著性終點,但SomaSignal檢測顯示0.4 mg組57%患者纖維化評分改善(安慰劑組16%)。動物實驗中,飲食誘導肥胖(DIO-MASH)和膽堿缺乏高脂飲食(CDA-HFD)模型均顯示司美格魯肽顯著降低膠原沉積(Picrosirius Red染色)和α平滑肌肌動蛋白(αSMA)表達。轉錄組分析發現,其下調Timp-1、MMP13等纖維化相關基因。

圖2 司美格魯肽治療效應對SomaScan適配體檢測平臺相關生物標志物的影響
循環蛋白質組的重塑
通過LASSO回歸篩選出的72種蛋白質構成“治療特征”,其中26種與體重變化無關。例如,血清蛋白酶抑制劑C1(SERPINC1)和載脂蛋白F(APOF)在MASH患者中低表達,經司美格魯肽治療后回升;而ADAMTSL2和氨基酸酰化酶1(ACY1)的過表達則被逆轉。獨立隊列驗證顯示,這些蛋白在健康人與MASH患者中存在差異表達,司美格魯肽使其趨向正常化。
機制探討與臨床意義
研究未在肝細胞、星狀細胞或庫普弗細胞中檢測到GLP-1受體表達,支持其通過外周代謝調控(如改善胰島素敏感性)和中樞抗炎通路間接作用。值得注意的是,ADAMTSL2和ACY1等蛋白同時與心血管疾病和肝細胞癌(HCC)風險相關,提示司美格魯肽可能具有多器官保護效應。
局限與展望
當前動物模型不能完全模擬人類MASH的復雜病理,且3期ESSENCE試驗的最終數據尚未公布。未來需進一步明確體重非依賴機制的具體靶點,并探索其對長期臨床結局(如肝硬化、HCC)的影響。
參考資料
[1] Modulation of metabolic, inflammatory and fibrotic pathways by semaglutide in metabolic dysfunction-associated steatohepatitis



