摘要:本研究揭示了DNA甲基轉移酶抑制劑地西他濱(DAC)通過激活miR-200a-3p來抑制致癌基因MNX1表達的新機制。
在血液系統惡性腫瘤中,急性髓系白血病(AML)因其侵襲性強、預后差而備受關注。這種疾病常伴隨表觀遺傳調控基因突變和基因組重排,其中7號染色體異常導致的致癌基因MNX1異常激活已成為近年研究熱點。MNX1本應在運動神經元和胰腺中表達,但在約1.4%的AML病例中,通過增強子劫持機制被異常激活,成為推動白血病發展的"幫兇"。德國癌癥研究中心(DKFZ Heidelberg)的Simge Kelekci等研究人員在《Leukemia》發表的研究,揭示了利用表觀遺傳藥物靶向這一致癌通路的新策略。
研究團隊采用了多組學聯用技術路線:首先通過shRNA基因敲降驗證MNX1對白血病細胞存活的關鍵作用;隨后篩選174種表觀遺傳化合物識別出DAC的特異性效應;結合miRNA測序和生物信息學預測鎖定miR-200a-3p調控機制;最后在患者來源異種移植(PDX)模型中進行治療驗證。樣本來源包括GDM-1細胞系和兩個MNX1表達的AML PDX模型(PDX491和PDX661)。
 圖1 DNA去甲基化介導急性髓系白血病中MNX1基因表達下調
圖1 DNA去甲基化介導急性髓系白血病中MNX1基因表達下調【MNX1抑制對白血病細胞的影響】
研究發現MNX1特異性shRNA可顯著降低GDM-1細胞活力,證實該基因是維持白血病生長的關鍵因素。這為后續尋找藥物靶向策略提供了理論基礎。
【表觀遺傳化合物篩選】
在174種化合物篩選中,DAC脫穎而出成為唯一能顯著抑制MNX1表達的制劑。值得注意的是,DAC對MNX1陽性的GDM-1細胞殺傷效果明顯優于其他AML細胞系,提示MNX1狀態可能影響治療敏感性。研究同時觀察到DAC誘導了包括MAGEA3、MAGEB2等癌癥睪丸抗原的表達激活。
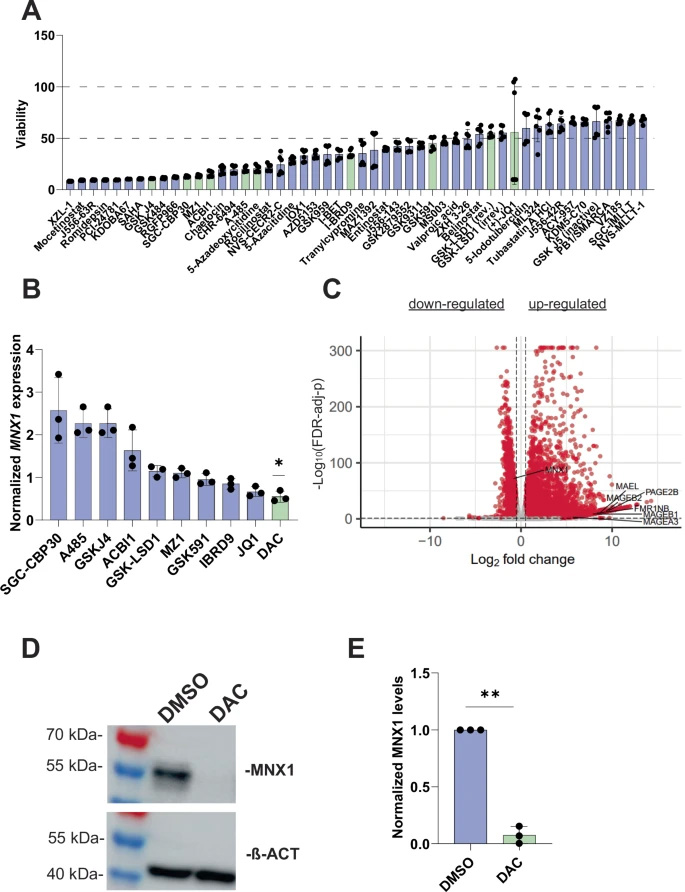
圖2 5-氮雜-2'-脫氧胞苷(DAC)介導的MNX1表達抑制
【miRNA調控機制解析】
通過miRNA測序發現DAC處理顯著上調了6種可能靶向MNX1 3'UTR的miRNA。其中miR-200a-3p的模擬物可使MNX1蛋白降至與DAC處理相當水平。熒光素酶報告實驗證實該miRNA通過結合MNX1 3'UTR發揮作用。甲基化分析顯示DAC通過去甲基化激活miR-200a-3p啟動子區。
【PDX模型驗證】
在兩種MNX1陽性AML PDX模型中,DAC處理同樣導致MNX1表達下調和miR-200a-3p上調,重現了細胞系中的發現。這為臨床轉化提供了重要依據。
該研究系統闡明了DAC通過DNA去甲基化激活miR-200a-3p、進而抑制MNX1表達的雙重作用機制。這一發現對具有t(7;12)易位的兒童AML和del(7q)的老年AML患者尤其重要,為這類難治性AML提供了精準治療的理論基礎。研究者建議未來可探索DAC與BET抑制劑等表觀遺傳藥物的聯合方案,通過同時干擾增強子-啟動子相互作用和DNA甲基化來增強療效。盡管miR-200a-3p被確認為關鍵介質,但研究者也指出可能存在其他調控途徑,這為后續機制研究指明了方向。這項成果不僅拓展了對AML表觀遺傳調控的認識,也為開發針對基因組結構變異所致癌基因激活的治療策略提供了新思路。
參考資料
[1] DNA demethylation-mediated downregulation of MNX1 in acute myeloid leukemia
摘要:本研究揭示了DNA甲基轉移酶抑制劑地西他濱(DAC)通過激活miR-200a-3p來抑制致癌基因MNX1表達的新機制。
在血液系統惡性腫瘤中,急性髓系白血病(AML)因其侵襲性強、預后差而備受關注。這種疾病常伴隨表觀遺傳調控基因突變和基因組重排,其中7號染色體異常導致的致癌基因MNX1異常激活已成為近年研究熱點。MNX1本應在運動神經元和胰腺中表達,但在約1.4%的AML病例中,通過增強子劫持機制被異常激活,成為推動白血病發展的"幫兇"。德國癌癥研究中心(DKFZ Heidelberg)的Simge Kelekci等研究人員在《Leukemia》發表的研究,揭示了利用表觀遺傳藥物靶向這一致癌通路的新策略。
研究團隊采用了多組學聯用技術路線:首先通過shRNA基因敲降驗證MNX1對白血病細胞存活的關鍵作用;隨后篩選174種表觀遺傳化合物識別出DAC的特異性效應;結合miRNA測序和生物信息學預測鎖定miR-200a-3p調控機制;最后在患者來源異種移植(PDX)模型中進行治療驗證。樣本來源包括GDM-1細胞系和兩個MNX1表達的AML PDX模型(PDX491和PDX661)。
 圖1 DNA去甲基化介導急性髓系白血病中MNX1基因表達下調
圖1 DNA去甲基化介導急性髓系白血病中MNX1基因表達下調【MNX1抑制對白血病細胞的影響】
研究發現MNX1特異性shRNA可顯著降低GDM-1細胞活力,證實該基因是維持白血病生長的關鍵因素。這為后續尋找藥物靶向策略提供了理論基礎。
【表觀遺傳化合物篩選】
在174種化合物篩選中,DAC脫穎而出成為唯一能顯著抑制MNX1表達的制劑。值得注意的是,DAC對MNX1陽性的GDM-1細胞殺傷效果明顯優于其他AML細胞系,提示MNX1狀態可能影響治療敏感性。研究同時觀察到DAC誘導了包括MAGEA3、MAGEB2等癌癥睪丸抗原的表達激活。

圖2 5-氮雜-2'-脫氧胞苷(DAC)介導的MNX1表達抑制
【miRNA調控機制解析】
通過miRNA測序發現DAC處理顯著上調了6種可能靶向MNX1 3'UTR的miRNA。其中miR-200a-3p的模擬物可使MNX1蛋白降至與DAC處理相當水平。熒光素酶報告實驗證實該miRNA通過結合MNX1 3'UTR發揮作用。甲基化分析顯示DAC通過去甲基化激活miR-200a-3p啟動子區。
【PDX模型驗證】
在兩種MNX1陽性AML PDX模型中,DAC處理同樣導致MNX1表達下調和miR-200a-3p上調,重現了細胞系中的發現。這為臨床轉化提供了重要依據。
該研究系統闡明了DAC通過DNA去甲基化激活miR-200a-3p、進而抑制MNX1表達的雙重作用機制。這一發現對具有t(7;12)易位的兒童AML和del(7q)的老年AML患者尤其重要,為這類難治性AML提供了精準治療的理論基礎。研究者建議未來可探索DAC與BET抑制劑等表觀遺傳藥物的聯合方案,通過同時干擾增強子-啟動子相互作用和DNA甲基化來增強療效。盡管miR-200a-3p被確認為關鍵介質,但研究者也指出可能存在其他調控途徑,這為后續機制研究指明了方向。這項成果不僅拓展了對AML表觀遺傳調控的認識,也為開發針對基因組結構變異所致癌基因激活的治療策略提供了新思路。
參考資料
[1] DNA demethylation-mediated downregulation of MNX1 in acute myeloid leukemia



