摘要:研究發現KDM4C通過調控GRHL2的K453甲基化,激活CTSL介導的組蛋白H3剪切,進而抑制GCLC表達導致氧化應激。
乳腺癌作為高度異質性疾病,基底型亞型因其三陰性特征(ER-/PR-/HER2-)和缺乏有效靶點,成為臨床治療難點。盡管表觀遺傳調控在腫瘤中的作用日益受到關注,但組蛋白去甲基化酶KDM4家族在乳腺癌中的具體機制仍不明確。尤其令人困惑的是,KDM4C在基底型乳腺癌中頻繁擴增,但其促癌機制與傳統組蛋白去甲基化功能(H3K9me3/H3K36me3)的關聯性存在矛盾。這些科學問題促使研究人員探索KDM4C在基底型乳腺癌中非經典作用機制。
美國Dana-Farber癌癥研究所等機構的研究團隊通過整合多組學分析和功能實驗,首次揭示KDM4C通過調控CTSL介導的組蛋白H3剪切影響腫瘤氧化還原平衡的全新機制。研究發現不僅解釋了KDM4C擴增型腫瘤的獨特依賴性,還為靶向表觀遺傳-代謝交叉調控提供了理論依據,相關成果發表在《Nature Genetics》期刊。
 圖1 抑制 KDM4C 可通過促進組織蛋白酶 L 介導的組蛋白 H3 剪切來阻斷基底型乳腺癌的腫瘤生長。
圖1 抑制 KDM4C 可通過促進組織蛋白酶 L 介導的組蛋白 H3 剪切來阻斷基底型乳腺癌的腫瘤生長。研究主要采用CRISPR-Cas9基因編輯構建CTSL敲除模型,結合RNA-seq和ChIP-seq分析轉錄組和染色質狀態變化,通過質譜技術檢測組蛋白修飾和代謝物變化,并利用患者來源異種移植(PDX)模型驗證治療靶點。此外,采用高通量藥物篩選平臺PRISM評估KDM4抑制劑QC6352的療效。
KDM4C在乳腺癌中的擴增特征與功能
通過TCGA和METABRIC隊列分析發現KDM4C在基底型乳腺癌中特異性擴增,且與不良預后相關。體外實驗顯示,KDM4C敲除或抑制劑(ML324/QC6352)處理能顯著抑制KDM4C擴增型細胞系的增殖,而催化活性缺失突變體(KDM4CS198M)無法挽救該表型,證實其促癌作用依賴去甲基化酶活性。值得注意的是,KDM4A/B敲除未產生類似效應,表明KDM4C在基底型乳腺癌中具有獨特功能。
KDM4C阻斷誘導的轉錄組與染色質重塑
RNA-seq分析發現KDM4C抑制主要下調膽固醇穩態和氧化磷酸化通路,同時激活TGF-β信號。ATAC-seq顯示染色質可及性廣泛改變,但H3K9me3/H3K36me3全局水平未見顯著變化。質譜分析意外發現組蛋白H3/H4 N端剪切現象,經蛋白酶抑制劑篩選確定CTSL為關鍵效應分子。免疫印跡證實KDM4C抑制導致H3 C端片段積累,該過程在CTSL敲除細胞中被阻斷。
CTSL的染色質招募與激活機制
ChIP-seq揭示CTSL通過GRHL2轉錄因子被招募至染色質。RIME和質譜分析發現KDM4C抑制導致GRHL2 K453單甲基化,而K453R突變體無法激活CTSL。Hi-ChIP證實CTSL介導的組蛋白剪切改變了染色質高級結構,這些變化與基因表達抑制顯著相關。
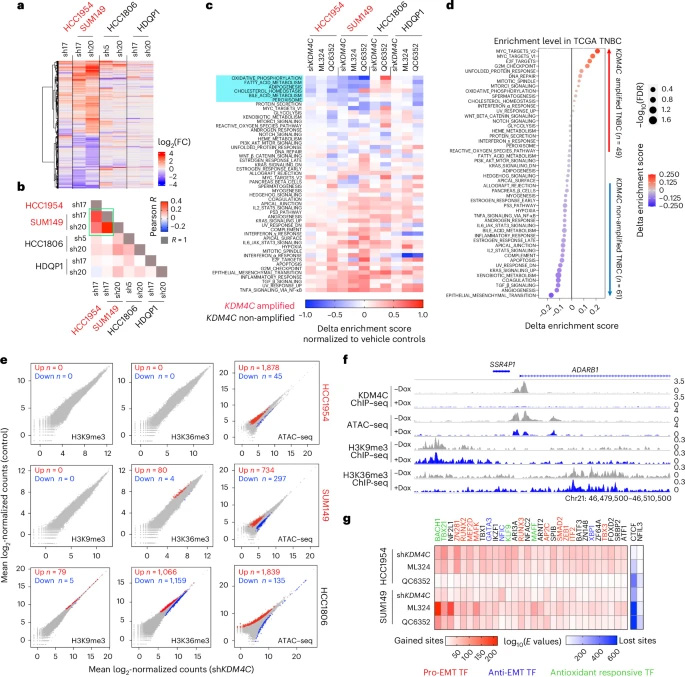
圖2 KDM4C抑制所致的轉錄組和染色質重塑
代謝重編程與氧化應激的調控回路
代謝組學顯示KDM4C抑制顯著降低GSH/GSSG水平,伴隨ROS升高。時間進程實驗表明GRHL2甲基化早于ROS升高,提示其作為初始觸發信號。機制上,CTSL剪切通過抑制GCLC啟動子可及性,阻斷GSH合成通路,形成正反饋循環增強CTSL活性。
臨床轉化價值
研究者構建的KDM4C/GSH雙靶向策略在PDX模型中顯示出與順鉑的協同效應。臨床數據分析顯示KDM4C特征與化療耐藥相關,為精準治療提供了生物標志物。
這項研究突破了傳統表觀遺傳調控框架,首次闡明KDM4C-CTSL-GCLC軸在基底型乳腺癌中的核心作用。該通路通過整合染色質重塑(CTSL介導的H3剪切)、轉錄調控(GRHL2甲基化)和代謝重編程(GSH合成抑制)三重機制,為理解表觀遺傳-代謝交互提供了新范式。更重要的是,研究發現為KDM4C擴增型乳腺癌的靶向治療開辟了新途徑,特別是針對難治性三陰性乳腺癌的聯合治療策略具有重要臨床轉化價值。
參考資料
[1] KDM4C inhibition blocks tumor growth in basal breast cancer by promoting cathepsin L-mediated histone H3 cleavage
摘要:研究發現KDM4C通過調控GRHL2的K453甲基化,激活CTSL介導的組蛋白H3剪切,進而抑制GCLC表達導致氧化應激。
乳腺癌作為高度異質性疾病,基底型亞型因其三陰性特征(ER-/PR-/HER2-)和缺乏有效靶點,成為臨床治療難點。盡管表觀遺傳調控在腫瘤中的作用日益受到關注,但組蛋白去甲基化酶KDM4家族在乳腺癌中的具體機制仍不明確。尤其令人困惑的是,KDM4C在基底型乳腺癌中頻繁擴增,但其促癌機制與傳統組蛋白去甲基化功能(H3K9me3/H3K36me3)的關聯性存在矛盾。這些科學問題促使研究人員探索KDM4C在基底型乳腺癌中非經典作用機制。
美國Dana-Farber癌癥研究所等機構的研究團隊通過整合多組學分析和功能實驗,首次揭示KDM4C通過調控CTSL介導的組蛋白H3剪切影響腫瘤氧化還原平衡的全新機制。研究發現不僅解釋了KDM4C擴增型腫瘤的獨特依賴性,還為靶向表觀遺傳-代謝交叉調控提供了理論依據,相關成果發表在《Nature Genetics》期刊。
 圖1 抑制 KDM4C 可通過促進組織蛋白酶 L 介導的組蛋白 H3 剪切來阻斷基底型乳腺癌的腫瘤生長。
圖1 抑制 KDM4C 可通過促進組織蛋白酶 L 介導的組蛋白 H3 剪切來阻斷基底型乳腺癌的腫瘤生長。研究主要采用CRISPR-Cas9基因編輯構建CTSL敲除模型,結合RNA-seq和ChIP-seq分析轉錄組和染色質狀態變化,通過質譜技術檢測組蛋白修飾和代謝物變化,并利用患者來源異種移植(PDX)模型驗證治療靶點。此外,采用高通量藥物篩選平臺PRISM評估KDM4抑制劑QC6352的療效。
KDM4C在乳腺癌中的擴增特征與功能
通過TCGA和METABRIC隊列分析發現KDM4C在基底型乳腺癌中特異性擴增,且與不良預后相關。體外實驗顯示,KDM4C敲除或抑制劑(ML324/QC6352)處理能顯著抑制KDM4C擴增型細胞系的增殖,而催化活性缺失突變體(KDM4CS198M)無法挽救該表型,證實其促癌作用依賴去甲基化酶活性。值得注意的是,KDM4A/B敲除未產生類似效應,表明KDM4C在基底型乳腺癌中具有獨特功能。
KDM4C阻斷誘導的轉錄組與染色質重塑
RNA-seq分析發現KDM4C抑制主要下調膽固醇穩態和氧化磷酸化通路,同時激活TGF-β信號。ATAC-seq顯示染色質可及性廣泛改變,但H3K9me3/H3K36me3全局水平未見顯著變化。質譜分析意外發現組蛋白H3/H4 N端剪切現象,經蛋白酶抑制劑篩選確定CTSL為關鍵效應分子。免疫印跡證實KDM4C抑制導致H3 C端片段積累,該過程在CTSL敲除細胞中被阻斷。
CTSL的染色質招募與激活機制
ChIP-seq揭示CTSL通過GRHL2轉錄因子被招募至染色質。RIME和質譜分析發現KDM4C抑制導致GRHL2 K453單甲基化,而K453R突變體無法激活CTSL。Hi-ChIP證實CTSL介導的組蛋白剪切改變了染色質高級結構,這些變化與基因表達抑制顯著相關。

圖2 KDM4C抑制所致的轉錄組和染色質重塑
代謝重編程與氧化應激的調控回路
代謝組學顯示KDM4C抑制顯著降低GSH/GSSG水平,伴隨ROS升高。時間進程實驗表明GRHL2甲基化早于ROS升高,提示其作為初始觸發信號。機制上,CTSL剪切通過抑制GCLC啟動子可及性,阻斷GSH合成通路,形成正反饋循環增強CTSL活性。
臨床轉化價值
研究者構建的KDM4C/GSH雙靶向策略在PDX模型中顯示出與順鉑的協同效應。臨床數據分析顯示KDM4C特征與化療耐藥相關,為精準治療提供了生物標志物。
這項研究突破了傳統表觀遺傳調控框架,首次闡明KDM4C-CTSL-GCLC軸在基底型乳腺癌中的核心作用。該通路通過整合染色質重塑(CTSL介導的H3剪切)、轉錄調控(GRHL2甲基化)和代謝重編程(GSH合成抑制)三重機制,為理解表觀遺傳-代謝交互提供了新范式。更重要的是,研究發現為KDM4C擴增型乳腺癌的靶向治療開辟了新途徑,特別是針對難治性三陰性乳腺癌的聯合治療策略具有重要臨床轉化價值。
參考資料
[1] KDM4C inhibition blocks tumor growth in basal breast cancer by promoting cathepsin L-mediated histone H3 cleavage



