摘要:研究發現,單細胞多模態分析有助于鑒定NSCLC腫瘤微環境中與免疫治療結局有關的表型特征
非小細胞肺癌(NSCLC)占肺癌病例的80%以上,仍然是全球癌癥相關死亡的主要原因。盡管免疫檢查點抑制劑已出現,但其療效僅限于27%至45%的患者。因此,鑒定可靠的生物標志物來預測治療應答至關重要。
近日,斯坦福大學領導的一項研究發現,單細胞多模態分析有助于鑒定NSCLC腫瘤微環境中與免疫治療結局有關的表型特征。
這項研究成果于5月23日發表在《Science Advances》雜志上,有望改善患者分層,并指導有效治療方案的選擇。
 圖1 單細胞多模態分析揭示非小細胞肺癌腫瘤微環境對治療反應的預測作用
圖1 單細胞多模態分析揭示非小細胞肺癌腫瘤微環境對治療反應的預測作用在這項研究中,斯坦福大學醫學院的Olivier Gevaert及其同事假設,整合多模態生物醫學數據集的腫瘤微環境信息可以指導醫生選擇有效的治療方案。
為了驗證這一假設,研究人員對132例NSCLC患者FFPE組織中腫瘤及周圍微環境的空間特征進行了分析。他們通過分析多重免疫熒光(mIF)圖像,檢測了33個生物標志物的表達水平,同時整合了115例和122例患者的全切片組織學圖像和RNA測序數據。
“我們的結果表明,與僅僅依賴單一數據模態相比,通過多模態數據分析整合每種模態的獨特優勢,可以提高治療應答預測的準確性,” 作者指出。
之后,為了鑒定與免疫治療應答相關的腫瘤微環境特征,研究人員采集了34例患者接受PD-1/PD-L1抗體治療前的腫瘤樣本。這些患者被分為應答者(n =11)和無應答者(n = 23)。
他們發現,細胞毒性T(Tc)細胞的比例及其與腫瘤微環境中抗原呈遞細胞的空間鄰近程度與免疫治療應答的增強有關。
根據發現的空間特征,研究人員開發出一種名為NucSegAI的深度學習模型,可用于細胞核分割和細胞分類。利用該模型,他們分析了119張全切片圖像中約4,560萬個細胞。
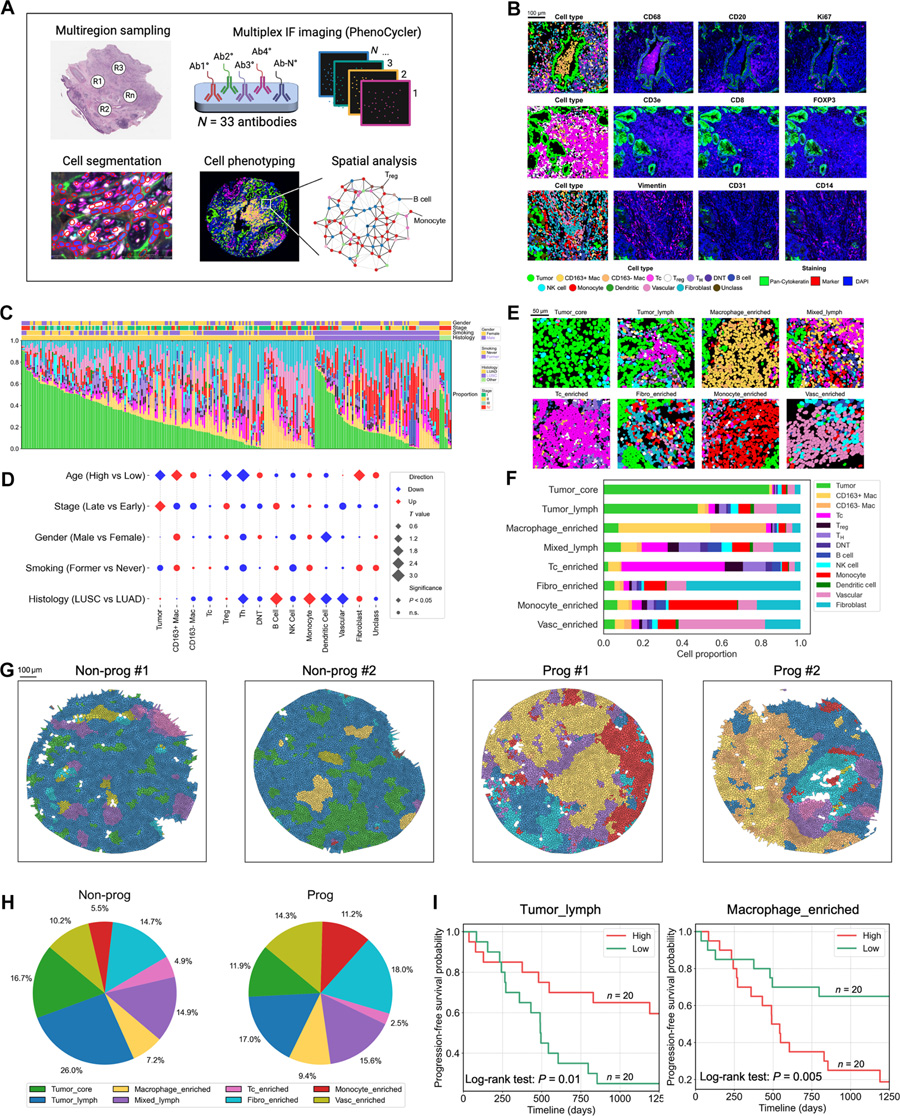
圖2 基于多重免疫熒光成像(mIF)的非小細胞肺癌組織微環境表征
NucSegAI發現了1,970萬個腫瘤細胞、1,230萬個淋巴細胞、960萬個成纖維細胞、330萬個巨噬細胞和70萬個血管細胞。接下來,他們利用單細胞形態和拓撲分析(sc-MTOP)進一步分析了腫瘤細胞內及周圍的各種淋巴細胞,將它們分為12個表型簇(Lym0到Lym11)。
研究人員發現,在對免疫檢查點治療產生應答的NSCLC患者中,腫瘤組織內Lym2表型簇的比例明顯高于無應答者,而Lym4表型簇的比例明顯低于無應答者。
作者報告稱:“利用淋巴細胞表型在鑒定治療應答者方面達到了0.78的AUC,優于傳統的PD-1 IHC評分。我們的方法提供了一種自動化的可擴展方法,可從組織學圖像中鑒定與臨床相關的空間細胞表型?!?/div>
總的來說,這項研究利用多模態數據集全面表征了NSCLC組織中的細胞多樣性、空間細胞關系和信號傳導環境。研究還鑒定出與癌癥進展相關的腫瘤微環境特征,這有望指導患者選擇個性化的治療方法。
參考資料
[1] Single-cell multimodal analysis reveals tumor microenvironment predictive of treatment response in non–small cell lung cancer
摘要:研究發現,單細胞多模態分析有助于鑒定NSCLC腫瘤微環境中與免疫治療結局有關的表型特征
非小細胞肺癌(NSCLC)占肺癌病例的80%以上,仍然是全球癌癥相關死亡的主要原因。盡管免疫檢查點抑制劑已出現,但其療效僅限于27%至45%的患者。因此,鑒定可靠的生物標志物來預測治療應答至關重要。
近日,斯坦福大學領導的一項研究發現,單細胞多模態分析有助于鑒定NSCLC腫瘤微環境中與免疫治療結局有關的表型特征。
這項研究成果于5月23日發表在《Science Advances》雜志上,有望改善患者分層,并指導有效治療方案的選擇。
 圖1 單細胞多模態分析揭示非小細胞肺癌腫瘤微環境對治療反應的預測作用
圖1 單細胞多模態分析揭示非小細胞肺癌腫瘤微環境對治療反應的預測作用在這項研究中,斯坦福大學醫學院的Olivier Gevaert及其同事假設,整合多模態生物醫學數據集的腫瘤微環境信息可以指導醫生選擇有效的治療方案。
為了驗證這一假設,研究人員對132例NSCLC患者FFPE組織中腫瘤及周圍微環境的空間特征進行了分析。他們通過分析多重免疫熒光(mIF)圖像,檢測了33個生物標志物的表達水平,同時整合了115例和122例患者的全切片組織學圖像和RNA測序數據。
“我們的結果表明,與僅僅依賴單一數據模態相比,通過多模態數據分析整合每種模態的獨特優勢,可以提高治療應答預測的準確性,” 作者指出。
之后,為了鑒定與免疫治療應答相關的腫瘤微環境特征,研究人員采集了34例患者接受PD-1/PD-L1抗體治療前的腫瘤樣本。這些患者被分為應答者(n =11)和無應答者(n = 23)。
他們發現,細胞毒性T(Tc)細胞的比例及其與腫瘤微環境中抗原呈遞細胞的空間鄰近程度與免疫治療應答的增強有關。
根據發現的空間特征,研究人員開發出一種名為NucSegAI的深度學習模型,可用于細胞核分割和細胞分類。利用該模型,他們分析了119張全切片圖像中約4,560萬個細胞。

圖2 基于多重免疫熒光成像(mIF)的非小細胞肺癌組織微環境表征
NucSegAI發現了1,970萬個腫瘤細胞、1,230萬個淋巴細胞、960萬個成纖維細胞、330萬個巨噬細胞和70萬個血管細胞。接下來,他們利用單細胞形態和拓撲分析(sc-MTOP)進一步分析了腫瘤細胞內及周圍的各種淋巴細胞,將它們分為12個表型簇(Lym0到Lym11)。
研究人員發現,在對免疫檢查點治療產生應答的NSCLC患者中,腫瘤組織內Lym2表型簇的比例明顯高于無應答者,而Lym4表型簇的比例明顯低于無應答者。
作者報告稱:“利用淋巴細胞表型在鑒定治療應答者方面達到了0.78的AUC,優于傳統的PD-1 IHC評分。我們的方法提供了一種自動化的可擴展方法,可從組織學圖像中鑒定與臨床相關的空間細胞表型?!?/div>
總的來說,這項研究利用多模態數據集全面表征了NSCLC組織中的細胞多樣性、空間細胞關系和信號傳導環境。研究還鑒定出與癌癥進展相關的腫瘤微環境特征,這有望指導患者選擇個性化的治療方法。
參考資料
[1] Single-cell multimodal analysis reveals tumor microenvironment predictive of treatment response in non–small cell lung cancer



