摘要:本研究揭示了衰老過程中小膠質(zhì)細(xì)胞(microglia)異常激活通過CXCL10-CXCR3軸招募CD8+T細(xì)胞,導(dǎo)致白質(zhì)退變和認(rèn)知功能下降的機(jī)制。
背景與問題
隨著年齡增長(zhǎng),大腦白質(zhì)會(huì)逐漸退化,表現(xiàn)為髓鞘結(jié)構(gòu)異常、軸突損傷和認(rèn)知功能下降。這種退變與神經(jīng)炎癥密切相關(guān),但具體機(jī)制尚未闡明。近年研究發(fā)現(xiàn),衰老大腦中會(huì)出現(xiàn)小膠質(zhì)細(xì)胞(microglia)異常激活和CD8+T細(xì)胞浸潤(rùn)的現(xiàn)象,但這些免疫細(xì)胞如何相互作用并加劇神經(jīng)退變?nèi)允俏唇庵i。
 圖1 小膠質(zhì)細(xì)胞激活調(diào)控CXCL10介導(dǎo)的CD8+ T細(xì)胞募集,促進(jìn)衰老相關(guān)白質(zhì)變性
圖1 小膠質(zhì)細(xì)胞激活調(diào)控CXCL10介導(dǎo)的CD8+ T細(xì)胞募集,促進(jìn)衰老相關(guān)白質(zhì)變性研究設(shè)計(jì)與意義
來自德國(guó)維爾茨堡大學(xué)和德國(guó)神經(jīng)退行性疾病中心(DZNE)的Janos Groh團(tuán)隊(duì)在《Nature Neuroscience》發(fā)表研究,首次揭示小膠質(zhì)細(xì)胞通過CXCL10-CXCR3化學(xué)趨化軸招募CD8+T細(xì)胞,進(jìn)而驅(qū)動(dòng)衰老相關(guān)白質(zhì)退變的完整機(jī)制。該研究不僅闡明了神經(jīng)-免疫互作在衰老中的關(guān)鍵作用,還為阿爾茨海默病、多發(fā)性硬化等年齡相關(guān)神經(jīng)疾病提供了潛在治療靶點(diǎn)。
關(guān)鍵技術(shù)方法
研究采用PLX5622藥物誘導(dǎo)小膠質(zhì)細(xì)胞耗竭、CX3CR1基因敲除小鼠模型,結(jié)合單細(xì)胞RNA測(cè)序(scRNA-seq)和多重錯(cuò)誤魯棒熒光原位雜交(MERFISH)空間轉(zhuǎn)錄組技術(shù)分析白質(zhì)區(qū)域細(xì)胞互作。通過流式細(xì)胞術(shù)、免疫電鏡和視覺行為學(xué)檢測(cè)(OptoDrum)驗(yàn)證表型,并利用人腦尸檢樣本進(jìn)行臨床相關(guān)性分析。
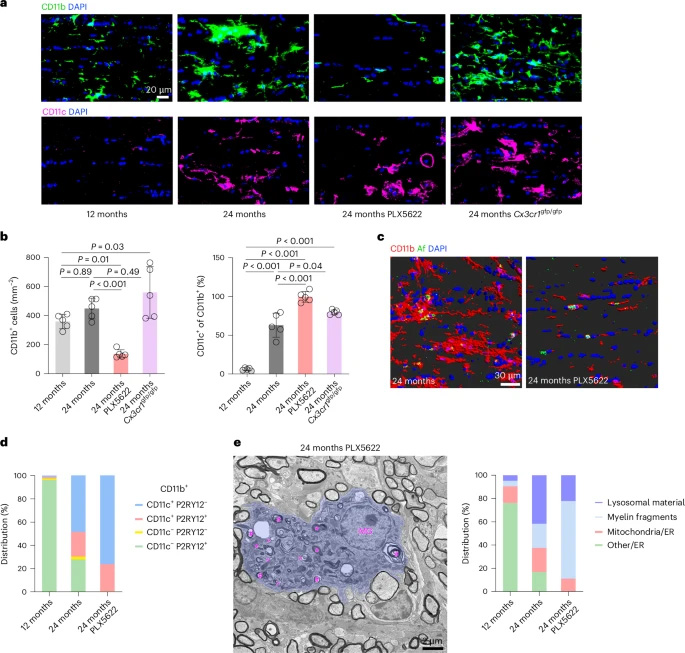
圖2 小膠質(zhì)細(xì)胞對(duì)PLX5622處理或衰老視神經(jīng)中CX3CR1缺失的應(yīng)答
主要研究結(jié)果
1. 小膠質(zhì)細(xì)胞異常激活加劇白質(zhì)衰老
通過比較12月齡(成年)和24月齡(老年)小鼠視神經(jīng)發(fā)現(xiàn):老年組出現(xiàn)髓鞘冗余/碎片化(redundant/fragmented myelin)、軸突球狀體(axonal spheroids)等退行性病變。PLX5622處理(耗竭小膠質(zhì)細(xì)胞)或CX3CR1缺失會(huì)加重這些病變,并伴隨CD11c+活化小膠質(zhì)細(xì)胞積聚和視覺功能下降。
2. CD8+T細(xì)胞是軸突退變的直接效應(yīng)者
在Cd8-/-小鼠中,PLX5622處理不再引起軸突損傷和視網(wǎng)膜神經(jīng)節(jié)細(xì)胞(RGCs)丟失。單細(xì)胞測(cè)序顯示老年小鼠白質(zhì)中CD8+T細(xì)胞高表達(dá)顆粒酶B(GZMB)等細(xì)胞毒性分子,并與退變軸突共定位。
3. MERFISH解析CXCL10+細(xì)胞生態(tài)位
空間轉(zhuǎn)錄組發(fā)現(xiàn)CD8+T細(xì)胞傾向于聚集在CXCL10+反應(yīng)性星形膠質(zhì)細(xì)胞和小膠質(zhì)細(xì)胞周圍。在Cxcl10-/-或Cxcr3-/-骨髓嵌合小鼠中,CD8+T細(xì)胞浸潤(rùn)減少,白質(zhì)退變得以緩解。
4. TREM2調(diào)控小膠質(zhì)-星形膠質(zhì)細(xì)胞對(duì)話
Trem2-/-小鼠的小膠質(zhì)細(xì)胞無法向WAM(white matter-associated microglia)狀態(tài)轉(zhuǎn)化,導(dǎo)致CXCL10表達(dá)降低和CD8+T細(xì)胞募集減少,證實(shí)TREM2是神經(jīng)免疫調(diào)控的關(guān)鍵節(jié)點(diǎn)。
結(jié)論與展望
該研究建立了"衰老→髓鞘損傷→小膠質(zhì)細(xì)胞活化→CXCL10釋放→CD8+TRM細(xì)胞浸潤(rùn)→軸突退變"的完整病理鏈條。特別值得注意的是,團(tuán)隊(duì)在人類前扣帶回皮層樣本中同樣觀察到CD8+TRM細(xì)胞的年齡相關(guān)性積聚,證實(shí)該機(jī)制在人類神經(jīng)系統(tǒng)中的保守性。這一發(fā)現(xiàn)為開發(fā)針對(duì)CXCL10-CXCR3軸的神經(jīng)保護(hù)策略提供了理論依據(jù),未來或可通過調(diào)節(jié)小膠質(zhì)細(xì)胞狀態(tài)來延緩衰老相關(guān)的認(rèn)知衰退。
參考資料
[1] Microglia activation orchestrates CXCL10-mediated CD8+ T cell recruitment to promote aging-related white matter degeneration
摘要:本研究揭示了衰老過程中小膠質(zhì)細(xì)胞(microglia)異常激活通過CXCL10-CXCR3軸招募CD8+T細(xì)胞,導(dǎo)致白質(zhì)退變和認(rèn)知功能下降的機(jī)制。
背景與問題
隨著年齡增長(zhǎng),大腦白質(zhì)會(huì)逐漸退化,表現(xiàn)為髓鞘結(jié)構(gòu)異常、軸突損傷和認(rèn)知功能下降。這種退變與神經(jīng)炎癥密切相關(guān),但具體機(jī)制尚未闡明。近年研究發(fā)現(xiàn),衰老大腦中會(huì)出現(xiàn)小膠質(zhì)細(xì)胞(microglia)異常激活和CD8+T細(xì)胞浸潤(rùn)的現(xiàn)象,但這些免疫細(xì)胞如何相互作用并加劇神經(jīng)退變?nèi)允俏唇庵i。
 圖1 小膠質(zhì)細(xì)胞激活調(diào)控CXCL10介導(dǎo)的CD8+ T細(xì)胞募集,促進(jìn)衰老相關(guān)白質(zhì)變性
圖1 小膠質(zhì)細(xì)胞激活調(diào)控CXCL10介導(dǎo)的CD8+ T細(xì)胞募集,促進(jìn)衰老相關(guān)白質(zhì)變性研究設(shè)計(jì)與意義
來自德國(guó)維爾茨堡大學(xué)和德國(guó)神經(jīng)退行性疾病中心(DZNE)的Janos Groh團(tuán)隊(duì)在《Nature Neuroscience》發(fā)表研究,首次揭示小膠質(zhì)細(xì)胞通過CXCL10-CXCR3化學(xué)趨化軸招募CD8+T細(xì)胞,進(jìn)而驅(qū)動(dòng)衰老相關(guān)白質(zhì)退變的完整機(jī)制。該研究不僅闡明了神經(jīng)-免疫互作在衰老中的關(guān)鍵作用,還為阿爾茨海默病、多發(fā)性硬化等年齡相關(guān)神經(jīng)疾病提供了潛在治療靶點(diǎn)。
關(guān)鍵技術(shù)方法
研究采用PLX5622藥物誘導(dǎo)小膠質(zhì)細(xì)胞耗竭、CX3CR1基因敲除小鼠模型,結(jié)合單細(xì)胞RNA測(cè)序(scRNA-seq)和多重錯(cuò)誤魯棒熒光原位雜交(MERFISH)空間轉(zhuǎn)錄組技術(shù)分析白質(zhì)區(qū)域細(xì)胞互作。通過流式細(xì)胞術(shù)、免疫電鏡和視覺行為學(xué)檢測(cè)(OptoDrum)驗(yàn)證表型,并利用人腦尸檢樣本進(jìn)行臨床相關(guān)性分析。

圖2 小膠質(zhì)細(xì)胞對(duì)PLX5622處理或衰老視神經(jīng)中CX3CR1缺失的應(yīng)答
主要研究結(jié)果
1. 小膠質(zhì)細(xì)胞異常激活加劇白質(zhì)衰老
通過比較12月齡(成年)和24月齡(老年)小鼠視神經(jīng)發(fā)現(xiàn):老年組出現(xiàn)髓鞘冗余/碎片化(redundant/fragmented myelin)、軸突球狀體(axonal spheroids)等退行性病變。PLX5622處理(耗竭小膠質(zhì)細(xì)胞)或CX3CR1缺失會(huì)加重這些病變,并伴隨CD11c+活化小膠質(zhì)細(xì)胞積聚和視覺功能下降。
2. CD8+T細(xì)胞是軸突退變的直接效應(yīng)者
在Cd8-/-小鼠中,PLX5622處理不再引起軸突損傷和視網(wǎng)膜神經(jīng)節(jié)細(xì)胞(RGCs)丟失。單細(xì)胞測(cè)序顯示老年小鼠白質(zhì)中CD8+T細(xì)胞高表達(dá)顆粒酶B(GZMB)等細(xì)胞毒性分子,并與退變軸突共定位。
3. MERFISH解析CXCL10+細(xì)胞生態(tài)位
空間轉(zhuǎn)錄組發(fā)現(xiàn)CD8+T細(xì)胞傾向于聚集在CXCL10+反應(yīng)性星形膠質(zhì)細(xì)胞和小膠質(zhì)細(xì)胞周圍。在Cxcl10-/-或Cxcr3-/-骨髓嵌合小鼠中,CD8+T細(xì)胞浸潤(rùn)減少,白質(zhì)退變得以緩解。
4. TREM2調(diào)控小膠質(zhì)-星形膠質(zhì)細(xì)胞對(duì)話
Trem2-/-小鼠的小膠質(zhì)細(xì)胞無法向WAM(white matter-associated microglia)狀態(tài)轉(zhuǎn)化,導(dǎo)致CXCL10表達(dá)降低和CD8+T細(xì)胞募集減少,證實(shí)TREM2是神經(jīng)免疫調(diào)控的關(guān)鍵節(jié)點(diǎn)。
結(jié)論與展望
該研究建立了"衰老→髓鞘損傷→小膠質(zhì)細(xì)胞活化→CXCL10釋放→CD8+TRM細(xì)胞浸潤(rùn)→軸突退變"的完整病理鏈條。特別值得注意的是,團(tuán)隊(duì)在人類前扣帶回皮層樣本中同樣觀察到CD8+TRM細(xì)胞的年齡相關(guān)性積聚,證實(shí)該機(jī)制在人類神經(jīng)系統(tǒng)中的保守性。這一發(fā)現(xiàn)為開發(fā)針對(duì)CXCL10-CXCR3軸的神經(jīng)保護(hù)策略提供了理論依據(jù),未來或可通過調(diào)節(jié)小膠質(zhì)細(xì)胞狀態(tài)來延緩衰老相關(guān)的認(rèn)知衰退。
參考資料
[1] Microglia activation orchestrates CXCL10-mediated CD8+ T cell recruitment to promote aging-related white matter degeneration



