摘要:研究人員分析了轉(zhuǎn)移性腎癌患者的血樣,作為免疫治療抵抗研究的一部分。
UT西南醫(yī)學(xué)中心研究人員發(fā)現(xiàn)的一種蛋白質(zhì)可能會(huì)導(dǎo)致對(duì)免疫檢查點(diǎn)抑制劑的耐藥性,這是一種廣泛用于治療癌癥的免疫療法。研究結(jié)果發(fā)表于Communications Medicine將糖蛋白非轉(zhuǎn)移性黑色素瘤蛋白B(GPNMB)與治療后復(fù)發(fā)聯(lián)系起來(lái),并表明它可能有助于腫瘤逃避轉(zhuǎn)移性腎細(xì)胞癌的免疫監(jiān)視。
 圖1 對(duì)免疫檢查點(diǎn)療法產(chǎn)生獲得性耐藥性的機(jī)制由糖蛋白非轉(zhuǎn)移性黑色素瘤蛋白B(GPNMB)信號(hào)級(jí)聯(lián)反應(yīng)所引發(fā)
圖1 對(duì)免疫檢查點(diǎn)療法產(chǎn)生獲得性耐藥性的機(jī)制由糖蛋白非轉(zhuǎn)移性黑色素瘤蛋白B(GPNMB)信號(hào)級(jí)聯(lián)反應(yīng)所引發(fā)研究負(fù)責(zé)人說(shuō):“發(fā)現(xiàn)血清GPNMB作為獲得性耐藥性的預(yù)測(cè)因子和克服癌癥免疫治療耐藥性的潛在靶點(diǎn),有助于進(jìn)一步改善癌癥患者的預(yù)后。”皮膚病科UT Southwestern和哈羅德·西蒙斯綜合癌癥中心 Kiyoshi Ariizumi教授說(shuō)。
Kiyoshi Ariizumi博士是猶他州西南大學(xué)皮膚科教授,也是哈羅德·C·西蒙斯綜合癌癥中心的成員。
檢查點(diǎn)抑制劑通過(guò)消除阻止免疫細(xì)胞識(shí)別和消除腫瘤的分子“剎車”,提高了許多晚期癌癥患者的生存率。然而,最初對(duì)這種免疫治療有反應(yīng)的患者中,有一半以上在持續(xù)治療的幾個(gè)月到幾年內(nèi),由于獲得性耐藥性,最終復(fù)發(fā)。
為了更好地了解這種耐藥性是如何形成的,UT西南大學(xué)的研究人員分析了39名接受免疫檢查點(diǎn)抑制劑治療的轉(zhuǎn)移性腎癌患者的腫瘤和血液樣本。在最初反應(yīng)積極的患者中,28%的患者在兩年內(nèi)產(chǎn)生了耐藥性,與血液中GPNMB水平的升高相一致。通過(guò)比較治療前和疾病進(jìn)展后收集的樣本,該團(tuán)隊(duì)調(diào)查了可能導(dǎo)致復(fù)發(fā)的分子變化。
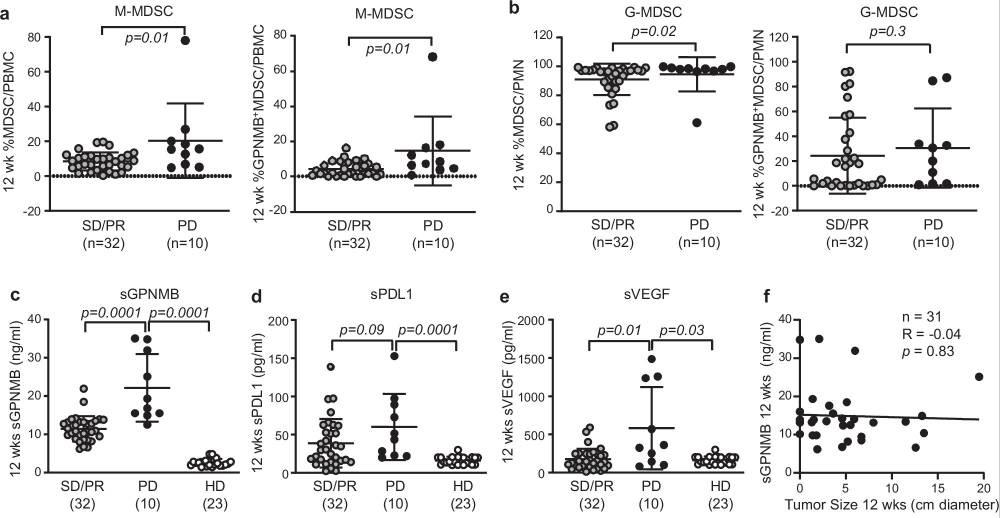
圖2 血液中可溶性糖蛋白非轉(zhuǎn)移性黑色素瘤蛋白B(sGPNMB)水平升高與免疫檢查點(diǎn)抑制劑(ICI)治療后12周時(shí)的腫瘤進(jìn)展顯著相關(guān)
另一方面,在細(xì)胞應(yīng)激期間,核糖體活動(dòng)通常會(huì)減少,因此可供發(fā)生碰撞的核糖體數(shù)量減少。因此,含有m6A的mRNA得以積累并轉(zhuǎn)化為應(yīng)激反應(yīng)蛋白。
Jaffrey博士說(shuō):“m6A途徑通常有助于抑制細(xì)胞的應(yīng)激反應(yīng),但我們知道在細(xì)胞應(yīng)激時(shí)一定有一個(gè)開(kāi)關(guān)將其關(guān)閉,而核糖體是這個(gè)開(kāi)關(guān)的關(guān)鍵要素。”
這項(xiàng)發(fā)現(xiàn)可能對(duì)癌癥治療具有啟示意義。新興的抗m6A療法通過(guò)抑制催化m6A在mRNA上形成的酶METTL3,正在進(jìn)行臨床試驗(yàn)。這項(xiàng)研究提出了這些藥物可能通過(guò)誘導(dǎo)應(yīng)激反應(yīng)蛋白的表達(dá)來(lái)發(fā)揮作用的可能性,而應(yīng)激反應(yīng)蛋白已知可以抑制某些癌細(xì)胞的生長(zhǎng)。
Jaffrey博士說(shuō):“我們的新發(fā)現(xiàn)為預(yù)測(cè)哪些類型的癌癥將對(duì)應(yīng)METTL3抑制劑提供了策略,這可以幫助我們識(shí)別出將對(duì)該療法反應(yīng)最佳的患者。”
參考資料
[1] Acquired resistance to immune checkpoint therapy is caused by glycoprotein non-metastatic melanoma protein B signal cascade
摘要:研究人員分析了轉(zhuǎn)移性腎癌患者的血樣,作為免疫治療抵抗研究的一部分。
UT西南醫(yī)學(xué)中心研究人員發(fā)現(xiàn)的一種蛋白質(zhì)可能會(huì)導(dǎo)致對(duì)免疫檢查點(diǎn)抑制劑的耐藥性,這是一種廣泛用于治療癌癥的免疫療法。研究結(jié)果發(fā)表于Communications Medicine將糖蛋白非轉(zhuǎn)移性黑色素瘤蛋白B(GPNMB)與治療后復(fù)發(fā)聯(lián)系起來(lái),并表明它可能有助于腫瘤逃避轉(zhuǎn)移性腎細(xì)胞癌的免疫監(jiān)視。
 圖1 對(duì)免疫檢查點(diǎn)療法產(chǎn)生獲得性耐藥性的機(jī)制由糖蛋白非轉(zhuǎn)移性黑色素瘤蛋白B(GPNMB)信號(hào)級(jí)聯(lián)反應(yīng)所引發(fā)
圖1 對(duì)免疫檢查點(diǎn)療法產(chǎn)生獲得性耐藥性的機(jī)制由糖蛋白非轉(zhuǎn)移性黑色素瘤蛋白B(GPNMB)信號(hào)級(jí)聯(lián)反應(yīng)所引發(fā)研究負(fù)責(zé)人說(shuō):“發(fā)現(xiàn)血清GPNMB作為獲得性耐藥性的預(yù)測(cè)因子和克服癌癥免疫治療耐藥性的潛在靶點(diǎn),有助于進(jìn)一步改善癌癥患者的預(yù)后。”皮膚病科UT Southwestern和哈羅德·西蒙斯綜合癌癥中心 Kiyoshi Ariizumi教授說(shuō)。
Kiyoshi Ariizumi博士是猶他州西南大學(xué)皮膚科教授,也是哈羅德·C·西蒙斯綜合癌癥中心的成員。
檢查點(diǎn)抑制劑通過(guò)消除阻止免疫細(xì)胞識(shí)別和消除腫瘤的分子“剎車”,提高了許多晚期癌癥患者的生存率。然而,最初對(duì)這種免疫治療有反應(yīng)的患者中,有一半以上在持續(xù)治療的幾個(gè)月到幾年內(nèi),由于獲得性耐藥性,最終復(fù)發(fā)。
為了更好地了解這種耐藥性是如何形成的,UT西南大學(xué)的研究人員分析了39名接受免疫檢查點(diǎn)抑制劑治療的轉(zhuǎn)移性腎癌患者的腫瘤和血液樣本。在最初反應(yīng)積極的患者中,28%的患者在兩年內(nèi)產(chǎn)生了耐藥性,與血液中GPNMB水平的升高相一致。通過(guò)比較治療前和疾病進(jìn)展后收集的樣本,該團(tuán)隊(duì)調(diào)查了可能導(dǎo)致復(fù)發(fā)的分子變化。

圖2 血液中可溶性糖蛋白非轉(zhuǎn)移性黑色素瘤蛋白B(sGPNMB)水平升高與免疫檢查點(diǎn)抑制劑(ICI)治療后12周時(shí)的腫瘤進(jìn)展顯著相關(guān)
另一方面,在細(xì)胞應(yīng)激期間,核糖體活動(dòng)通常會(huì)減少,因此可供發(fā)生碰撞的核糖體數(shù)量減少。因此,含有m6A的mRNA得以積累并轉(zhuǎn)化為應(yīng)激反應(yīng)蛋白。
Jaffrey博士說(shuō):“m6A途徑通常有助于抑制細(xì)胞的應(yīng)激反應(yīng),但我們知道在細(xì)胞應(yīng)激時(shí)一定有一個(gè)開(kāi)關(guān)將其關(guān)閉,而核糖體是這個(gè)開(kāi)關(guān)的關(guān)鍵要素。”
這項(xiàng)發(fā)現(xiàn)可能對(duì)癌癥治療具有啟示意義。新興的抗m6A療法通過(guò)抑制催化m6A在mRNA上形成的酶METTL3,正在進(jìn)行臨床試驗(yàn)。這項(xiàng)研究提出了這些藥物可能通過(guò)誘導(dǎo)應(yīng)激反應(yīng)蛋白的表達(dá)來(lái)發(fā)揮作用的可能性,而應(yīng)激反應(yīng)蛋白已知可以抑制某些癌細(xì)胞的生長(zhǎng)。
Jaffrey博士說(shuō):“我們的新發(fā)現(xiàn)為預(yù)測(cè)哪些類型的癌癥將對(duì)應(yīng)METTL3抑制劑提供了策略,這可以幫助我們識(shí)別出將對(duì)該療法反應(yīng)最佳的患者。”
參考資料
[1] Acquired resistance to immune checkpoint therapy is caused by glycoprotein non-metastatic melanoma protein B signal cascade



