摘要:研究人員開發(fā)的一種新方法可能會對癌癥治療產生深遠的影響。
我們的身體每天通過一種被稱為細胞凋亡的細胞剔除和周轉的自然過程剝離自己的600億個細胞。這些細胞;主要是血液和腸道細胞;但斯坦福大學醫(yī)學研究人員開發(fā)的一種新方法可能會對癌癥治療產生深遠的影響。
他們的目標是利用這種細胞死亡的自然方法來誘騙癌細胞進行自我處理。他們的方法是通過人為地將兩種蛋白質結合在一起,以一種新的化合物打開一組細胞死亡基因,最終驅動腫瘤細胞開啟自己的功能。研究人員在10月4日發(fā)表在《Science》雜志上的一篇論文中描述了他們最新的這種化合物。
 圖1 將激酶抑制劑轉化為基因治療的激活劑
圖1 將激酶抑制劑轉化為基因治療的激活劑Gerald Crabtree博士是一位長期從事癌癥研究的發(fā)育生物學教授,他是在加利福尼亞帕洛阿爾托西部國王山的森林里散步時想到這個想法的,他邊走邊思考生物學上的重大里程碑。他思考的一個里程碑是20世紀70年代的發(fā)現,即細胞觸發(fā)自身死亡是為了生物體的更大利益。細胞凋亡對許多生物過程至關重要,包括所有器官的正常發(fā)育和免疫系統(tǒng)的微調。該系統(tǒng)保留了病原體識別細胞,但殺死了自我識別細胞,從而預防自身免疫性疾病。
“我突然想到,嗯,這就是我們想要的治療癌癥的方式,”該研究的資深作者之一Gerald Crabtree說。“從本質上講,我們希望具有同樣的特異性,可以在沒有旁觀者的情況下消滅600億個細胞,這樣就不會有非殺傷機制適當目標的細胞被殺死。”
癌癥的傳統(tǒng)治療方法;即化療和放療;通常在殺死癌變細胞的同時殺死大量的健康細胞。為了利用細胞的自然和高度特異性的自我毀滅能力,研究小組開發(fā)了一種分子膠,可以將兩種通常彼此無關的蛋白質粘在一起。
翻轉癌癥腳本
其中一種叫做BCL6的蛋白質一旦發(fā)生突變,就會引發(fā)一種叫做彌漫性大細胞B細胞淋巴瘤的血癌。這種致癌蛋白也被稱為致癌基因。在淋巴瘤中,突變的BCL6位于促凋亡基因附近的DNA上,并使它們處于關閉狀態(tài),幫助癌細胞保持其標志性的不朽。
研究人員開發(fā)了一種分子,將BCL6連接到一種名為CDK9的蛋白質上,CDK9作為一種酶,催化基因激活,在這種情況下,開啟了BCL6通常關閉的一組凋亡基因。
“我們的想法是,你能把癌癥依賴轉化為殺死癌癥的信號嗎?”Nathanael Gray博士問道,他是Krishnan-Shah家族教授和化學和系統(tǒng)生物學教授Crabtree的共同資深作者。“你把癌癥依賴的東西找出來,然后反轉它的角色,讓它成為殺死癌細胞的東西。”
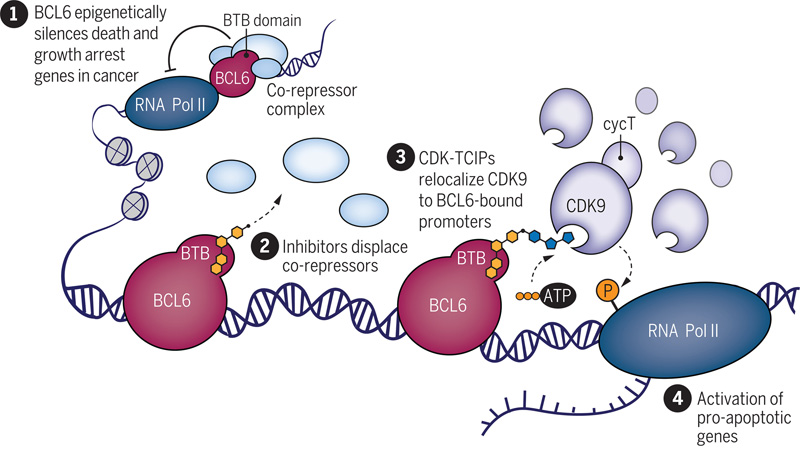
圖2 重新定位轉錄激酶以激活凋亡
這種方法;將癌細胞中關閉的東西打開;與許多其他類型的靶向癌癥療法相反,這些療法抑制了癌癥的特定驅動因素,關閉了正常開啟的某些東西。斯坦福大學醫(yī)學院博士后學者,該研究的第一作者之一Roman Sarott博士說:“自從致癌基因被發(fā)現以來,人們一直試圖在癌癥中關閉它們。相反,我們正試圖用它們來打開信號,我們希望這將證明對治療有益。”
當研究小組在實驗室中對彌漫性大細胞B細胞淋巴瘤細胞中的這種分子進行測試時,他們發(fā)現它確實能高效地殺死癌細胞。他們還在健康小鼠身上測試了這種分子,發(fā)現沒有明顯的毒副作用,盡管這種分子殺死了動物健康B細胞中的一種特定類型的免疫細胞,這種細胞也依賴于BCL6。他們現在正在患有彌漫性大B細胞淋巴瘤的小鼠身上測試這種化合物,以衡量它在活體動物身上殺死癌癥的能力。
由于這項技術依賴于細胞中BCL6和CDK9蛋白的天然供應,它似乎對淋巴瘤細胞非常特異性。BCL6蛋白只存在于這種淋巴瘤細胞和一種特定的B細胞中。研究人員在實驗室中對859種不同類型的癌細胞進行了這種分子測試;嵌合化合物只殺死彌漫性大細胞B細胞淋巴瘤細胞。
由于BCL6通常作用于13種不同的促進細胞凋亡的基因,研究人員希望他們的策略能夠避免癌癥中常見的治療耐藥性。癌癥通常能夠迅速適應只針對疾病一個弱點的治療方法,其中一些治療方法可能會在不完全殺死細胞的情況下阻止癌癥的生長。研究小組希望,通過同時向細胞發(fā)射多種不同的細胞死亡信號,癌癥將無法存活足夠長的時間來進化出耐藥性,盡管這一想法仍有待驗證。
“這是一種由委員會導致的細胞死亡,”博士后學者、該研究的第一作者之一Sai Gourisankar博士說。“一旦癌細胞死亡,這就是一種末期狀態(tài)。”
Crabtree和Gray都是斯坦福癌癥研究所的成員,也是一家生物技術初創(chuàng)公司Shenandoah Therapeutics的聯(lián)合創(chuàng)始人,該公司旨在進一步測試這種分子和一種類似的、先前開發(fā)的分子,希望收集足夠的臨床前數據,以支持開展這些化合物的臨床試驗。他們還計劃構建類似的分子,以其他致癌蛋白為目標,包括致癌基因Ras,它是幾種不同癌癥的驅動因子。
參考資料
[1] Relocalizing transcriptional kinases to activate apoptosis
摘要:研究人員開發(fā)的一種新方法可能會對癌癥治療產生深遠的影響。
我們的身體每天通過一種被稱為細胞凋亡的細胞剔除和周轉的自然過程剝離自己的600億個細胞。這些細胞;主要是血液和腸道細胞;但斯坦福大學醫(yī)學研究人員開發(fā)的一種新方法可能會對癌癥治療產生深遠的影響。
他們的目標是利用這種細胞死亡的自然方法來誘騙癌細胞進行自我處理。他們的方法是通過人為地將兩種蛋白質結合在一起,以一種新的化合物打開一組細胞死亡基因,最終驅動腫瘤細胞開啟自己的功能。研究人員在10月4日發(fā)表在《Science》雜志上的一篇論文中描述了他們最新的這種化合物。
 圖1 將激酶抑制劑轉化為基因治療的激活劑
圖1 將激酶抑制劑轉化為基因治療的激活劑Gerald Crabtree博士是一位長期從事癌癥研究的發(fā)育生物學教授,他是在加利福尼亞帕洛阿爾托西部國王山的森林里散步時想到這個想法的,他邊走邊思考生物學上的重大里程碑。他思考的一個里程碑是20世紀70年代的發(fā)現,即細胞觸發(fā)自身死亡是為了生物體的更大利益。細胞凋亡對許多生物過程至關重要,包括所有器官的正常發(fā)育和免疫系統(tǒng)的微調。該系統(tǒng)保留了病原體識別細胞,但殺死了自我識別細胞,從而預防自身免疫性疾病。
“我突然想到,嗯,這就是我們想要的治療癌癥的方式,”該研究的資深作者之一Gerald Crabtree說。“從本質上講,我們希望具有同樣的特異性,可以在沒有旁觀者的情況下消滅600億個細胞,這樣就不會有非殺傷機制適當目標的細胞被殺死。”
癌癥的傳統(tǒng)治療方法;即化療和放療;通常在殺死癌變細胞的同時殺死大量的健康細胞。為了利用細胞的自然和高度特異性的自我毀滅能力,研究小組開發(fā)了一種分子膠,可以將兩種通常彼此無關的蛋白質粘在一起。
翻轉癌癥腳本
其中一種叫做BCL6的蛋白質一旦發(fā)生突變,就會引發(fā)一種叫做彌漫性大細胞B細胞淋巴瘤的血癌。這種致癌蛋白也被稱為致癌基因。在淋巴瘤中,突變的BCL6位于促凋亡基因附近的DNA上,并使它們處于關閉狀態(tài),幫助癌細胞保持其標志性的不朽。
研究人員開發(fā)了一種分子,將BCL6連接到一種名為CDK9的蛋白質上,CDK9作為一種酶,催化基因激活,在這種情況下,開啟了BCL6通常關閉的一組凋亡基因。
“我們的想法是,你能把癌癥依賴轉化為殺死癌癥的信號嗎?”Nathanael Gray博士問道,他是Krishnan-Shah家族教授和化學和系統(tǒng)生物學教授Crabtree的共同資深作者。“你把癌癥依賴的東西找出來,然后反轉它的角色,讓它成為殺死癌細胞的東西。”

圖2 重新定位轉錄激酶以激活凋亡
這種方法;將癌細胞中關閉的東西打開;與許多其他類型的靶向癌癥療法相反,這些療法抑制了癌癥的特定驅動因素,關閉了正常開啟的某些東西。斯坦福大學醫(yī)學院博士后學者,該研究的第一作者之一Roman Sarott博士說:“自從致癌基因被發(fā)現以來,人們一直試圖在癌癥中關閉它們。相反,我們正試圖用它們來打開信號,我們希望這將證明對治療有益。”
當研究小組在實驗室中對彌漫性大細胞B細胞淋巴瘤細胞中的這種分子進行測試時,他們發(fā)現它確實能高效地殺死癌細胞。他們還在健康小鼠身上測試了這種分子,發(fā)現沒有明顯的毒副作用,盡管這種分子殺死了動物健康B細胞中的一種特定類型的免疫細胞,這種細胞也依賴于BCL6。他們現在正在患有彌漫性大B細胞淋巴瘤的小鼠身上測試這種化合物,以衡量它在活體動物身上殺死癌癥的能力。
由于這項技術依賴于細胞中BCL6和CDK9蛋白的天然供應,它似乎對淋巴瘤細胞非常特異性。BCL6蛋白只存在于這種淋巴瘤細胞和一種特定的B細胞中。研究人員在實驗室中對859種不同類型的癌細胞進行了這種分子測試;嵌合化合物只殺死彌漫性大細胞B細胞淋巴瘤細胞。
由于BCL6通常作用于13種不同的促進細胞凋亡的基因,研究人員希望他們的策略能夠避免癌癥中常見的治療耐藥性。癌癥通常能夠迅速適應只針對疾病一個弱點的治療方法,其中一些治療方法可能會在不完全殺死細胞的情況下阻止癌癥的生長。研究小組希望,通過同時向細胞發(fā)射多種不同的細胞死亡信號,癌癥將無法存活足夠長的時間來進化出耐藥性,盡管這一想法仍有待驗證。
“這是一種由委員會導致的細胞死亡,”博士后學者、該研究的第一作者之一Sai Gourisankar博士說。“一旦癌細胞死亡,這就是一種末期狀態(tài)。”
Crabtree和Gray都是斯坦福癌癥研究所的成員,也是一家生物技術初創(chuàng)公司Shenandoah Therapeutics的聯(lián)合創(chuàng)始人,該公司旨在進一步測試這種分子和一種類似的、先前開發(fā)的分子,希望收集足夠的臨床前數據,以支持開展這些化合物的臨床試驗。他們還計劃構建類似的分子,以其他致癌蛋白為目標,包括致癌基因Ras,它是幾種不同癌癥的驅動因子。
參考資料
[1] Relocalizing transcriptional kinases to activate apoptosis



