摘要:科學(xué)家已經(jīng)發(fā)現(xiàn)腸道中的某些大腸桿菌是如何通過與腸細胞結(jié)合并釋放一種破壞DNA的毒素來促進結(jié)腸癌的發(fā)生的。
科學(xué)家已經(jīng)發(fā)現(xiàn)腸道中的某些大腸桿菌是如何通過與腸細胞結(jié)合并釋放一種破壞dna的毒素來促進結(jié)腸癌的發(fā)生的。這項發(fā)表在《Nature》雜志上的研究揭示了一種潛在降低癌癥風(fēng)險的新方法。這項研究是由Lars Vereecke教授(VIB-UGent炎癥研究中心)和Han Remaut教授(VIB-VUB結(jié)構(gòu)生物學(xué)中心)的團隊進行的。

圖1 大腸桿菌素驅(qū)動的癌癥需要粘附素介導(dǎo)的上皮結(jié)合
細菌和結(jié)腸癌
結(jié)腸癌是第三大最常見和最致命的癌癥。令人震驚的是,其發(fā)病率正在上升,尤其是在年輕人中。新出現(xiàn)的證據(jù)表明,腸道微生物群中的某些細菌(腸道中主要健康細菌的集合)可以通過很大程度上未知的機制促進結(jié)腸癌的發(fā)展。其中一種被懷疑致癌的細菌是pks+大腸桿菌,它會產(chǎn)生一種名為“大腸桿菌蛋白”的基因毒素。大腸桿菌蛋白能夠結(jié)合并破壞人類DNA,導(dǎo)致突變,從而增加患癌癥的風(fēng)險。這些細菌及其引起的突變在結(jié)腸癌患者體內(nèi)明顯過量。到目前為止,人們還不清楚pks+大腸桿菌如何到達并破壞腸壁,從而促進癌癥的發(fā)展。Lars Vereecke教授(VIB-UGent)和Han Remaut教授(VIB-VUB)團隊的實驗表明,這些細菌在自由游動狀態(tài)和附著在腸道組織內(nèi)層(腸上皮)的模式之間切換。這種附著是通過特定的細菌毛來實現(xiàn)的,細菌毛是細菌表面的長而薄的蛋白質(zhì)纖維,最終形成粘連素,可以結(jié)合腸上皮細胞上的受體。
該研究的第一作者Maude Jans (VIB-UGent)說:“我們發(fā)現(xiàn)這種菌毛結(jié)合顯著增加了結(jié)腸腫瘤的數(shù)量、大小和侵襲性。”
該研究的資深作者Lars Vereecke教授(VIB-UGent)說:“我們的實驗表明,pks+大腸桿菌與腸上皮的結(jié)合可以被視為結(jié)腸癌發(fā)展的關(guān)鍵一步。我們發(fā)現(xiàn),通過干擾這些細菌附著機制,腫瘤的發(fā)展可以大大減弱。”
證據(jù)就在這本書里
該研究的第一作者之一Magdalena Kolata博士說:“我們能夠識別介導(dǎo)與結(jié)腸細胞結(jié)合的特定細菌粘附素:FimH和FmlH。我們推測,這些粘附素的結(jié)合允許細菌在上皮細胞附近產(chǎn)生基因毒素大腸桿菌蛋白,從而導(dǎo)致DNA損傷和癌癥的發(fā)展。”
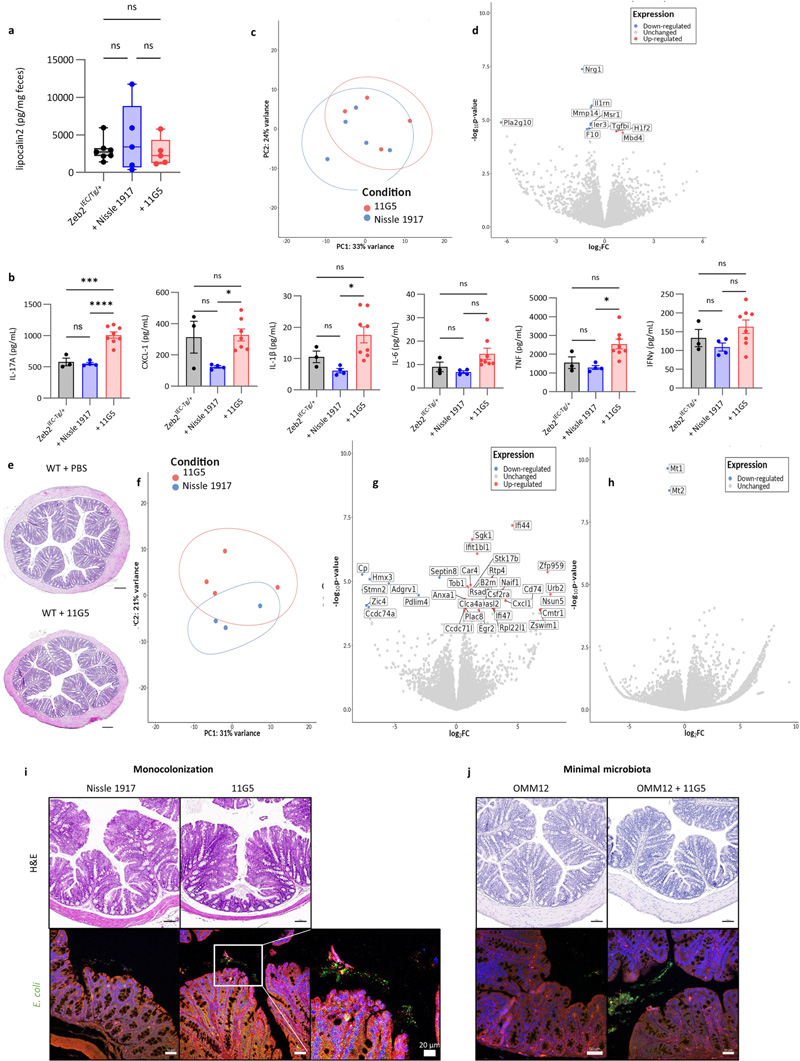
圖2 大腸桿菌11G5感染不會增加Zeb2IEC-Tg/+小鼠的結(jié)腸炎癥,也不會影響WT同窩小鼠的上皮細胞
果然,研究小組證明,去除粘附素會剝奪細菌傳遞大腸桿菌蛋白的能力,并導(dǎo)致DNA損傷。
“基于我們的發(fā)現(xiàn),我們測試了一種治療方法,使用阻斷這些基本細菌粘附素結(jié)合的分子來防止細菌附著。值得注意的是,我們可以在臨床前模型中大幅抑制DNA損傷和腫瘤的發(fā)展。這種治療方法非常有前途,因為它成功地針對有害的大腸桿菌菌株,而不影響有益的腸道微生物,這與抗生素不同。”
研究人員還強調(diào),西方的生活方式會使我們的腸壁更容易受到有害細菌的侵害,包括pks+大腸桿菌。新的研究結(jié)果還揭示了該領(lǐng)域一個普遍存在的謎團:一些被批準并用作益生菌(被認為能促進健康的活細菌)的大腸桿菌菌株攜帶pks基因,但在實驗室實驗中并未導(dǎo)致癌癥風(fēng)險增加。
“我們發(fā)現(xiàn)這些菌株確實產(chǎn)生大腸桿菌素,并且它們表達致病性菌株用來將毒素傳遞到上皮細胞的FimH和FmlH粘附素,”共同資深作者Han Remaut教授說。“事實證明,這些菌株含有一種FimH變體,這種變體的結(jié)合效果不太好,因此大腸桿菌毒素?zé)o法到達目標。”
然而,作者證明,僅僅幾個突變就足以恢復(fù)這些菌株的強FimH結(jié)合和遺傳毒性活性,強調(diào)它們作為良性益生菌的考慮可能需要重新考慮。
參考資料
[1] Colibactin-driven colon cancer requires adhesin-mediated epithelial binding
摘要:科學(xué)家已經(jīng)發(fā)現(xiàn)腸道中的某些大腸桿菌是如何通過與腸細胞結(jié)合并釋放一種破壞DNA的毒素來促進結(jié)腸癌的發(fā)生的。
科學(xué)家已經(jīng)發(fā)現(xiàn)腸道中的某些大腸桿菌是如何通過與腸細胞結(jié)合并釋放一種破壞dna的毒素來促進結(jié)腸癌的發(fā)生的。這項發(fā)表在《Nature》雜志上的研究揭示了一種潛在降低癌癥風(fēng)險的新方法。這項研究是由Lars Vereecke教授(VIB-UGent炎癥研究中心)和Han Remaut教授(VIB-VUB結(jié)構(gòu)生物學(xué)中心)的團隊進行的。

圖1 大腸桿菌素驅(qū)動的癌癥需要粘附素介導(dǎo)的上皮結(jié)合
細菌和結(jié)腸癌
結(jié)腸癌是第三大最常見和最致命的癌癥。令人震驚的是,其發(fā)病率正在上升,尤其是在年輕人中。新出現(xiàn)的證據(jù)表明,腸道微生物群中的某些細菌(腸道中主要健康細菌的集合)可以通過很大程度上未知的機制促進結(jié)腸癌的發(fā)展。其中一種被懷疑致癌的細菌是pks+大腸桿菌,它會產(chǎn)生一種名為“大腸桿菌蛋白”的基因毒素。大腸桿菌蛋白能夠結(jié)合并破壞人類DNA,導(dǎo)致突變,從而增加患癌癥的風(fēng)險。這些細菌及其引起的突變在結(jié)腸癌患者體內(nèi)明顯過量。到目前為止,人們還不清楚pks+大腸桿菌如何到達并破壞腸壁,從而促進癌癥的發(fā)展。Lars Vereecke教授(VIB-UGent)和Han Remaut教授(VIB-VUB)團隊的實驗表明,這些細菌在自由游動狀態(tài)和附著在腸道組織內(nèi)層(腸上皮)的模式之間切換。這種附著是通過特定的細菌毛來實現(xiàn)的,細菌毛是細菌表面的長而薄的蛋白質(zhì)纖維,最終形成粘連素,可以結(jié)合腸上皮細胞上的受體。
該研究的第一作者Maude Jans (VIB-UGent)說:“我們發(fā)現(xiàn)這種菌毛結(jié)合顯著增加了結(jié)腸腫瘤的數(shù)量、大小和侵襲性。”
該研究的資深作者Lars Vereecke教授(VIB-UGent)說:“我們的實驗表明,pks+大腸桿菌與腸上皮的結(jié)合可以被視為結(jié)腸癌發(fā)展的關(guān)鍵一步。我們發(fā)現(xiàn),通過干擾這些細菌附著機制,腫瘤的發(fā)展可以大大減弱。”
證據(jù)就在這本書里
該研究的第一作者之一Magdalena Kolata博士說:“我們能夠識別介導(dǎo)與結(jié)腸細胞結(jié)合的特定細菌粘附素:FimH和FmlH。我們推測,這些粘附素的結(jié)合允許細菌在上皮細胞附近產(chǎn)生基因毒素大腸桿菌蛋白,從而導(dǎo)致DNA損傷和癌癥的發(fā)展。”

圖2 大腸桿菌11G5感染不會增加Zeb2IEC-Tg/+小鼠的結(jié)腸炎癥,也不會影響WT同窩小鼠的上皮細胞
果然,研究小組證明,去除粘附素會剝奪細菌傳遞大腸桿菌蛋白的能力,并導(dǎo)致DNA損傷。
“基于我們的發(fā)現(xiàn),我們測試了一種治療方法,使用阻斷這些基本細菌粘附素結(jié)合的分子來防止細菌附著。值得注意的是,我們可以在臨床前模型中大幅抑制DNA損傷和腫瘤的發(fā)展。這種治療方法非常有前途,因為它成功地針對有害的大腸桿菌菌株,而不影響有益的腸道微生物,這與抗生素不同。”
研究人員還強調(diào),西方的生活方式會使我們的腸壁更容易受到有害細菌的侵害,包括pks+大腸桿菌。新的研究結(jié)果還揭示了該領(lǐng)域一個普遍存在的謎團:一些被批準并用作益生菌(被認為能促進健康的活細菌)的大腸桿菌菌株攜帶pks基因,但在實驗室實驗中并未導(dǎo)致癌癥風(fēng)險增加。
“我們發(fā)現(xiàn)這些菌株確實產(chǎn)生大腸桿菌素,并且它們表達致病性菌株用來將毒素傳遞到上皮細胞的FimH和FmlH粘附素,”共同資深作者Han Remaut教授說。“事實證明,這些菌株含有一種FimH變體,這種變體的結(jié)合效果不太好,因此大腸桿菌毒素?zé)o法到達目標。”
然而,作者證明,僅僅幾個突變就足以恢復(fù)這些菌株的強FimH結(jié)合和遺傳毒性活性,強調(diào)它們作為良性益生菌的考慮可能需要重新考慮。
參考資料
[1] Colibactin-driven colon cancer requires adhesin-mediated epithelial binding



