摘要:一項研究揭示了膀胱癌的起源和發展過程
威爾康奈爾醫學院和紐約基因組中心的研究人員領導的一項研究揭示了膀胱癌的起源和發展過程,這是前所未有的。研究人員發現,使正常細胞和癌細胞的DNA發生突變的抗病毒酶是早期膀胱癌發展的關鍵促進因素,而標準化療也是突變的一個有力來源。研究人員還發現,腫瘤細胞中異常環狀DNA結構中過度活躍的基因會導致膀胱癌對治療產生耐藥性。這些發現是對膀胱癌生物學的新見解,并為這種難以治療的癌癥提供了新的治療策略。
這項研究發表在《自然》雜志上,重點研究了膀胱癌的主要形式——尿路上皮癌,它起源于膀胱、尿道和腎臟排尿管的細胞。研究人員檢查了來自同一組處于不同疾病階段的患者的惡性和惡性前尿路上皮細胞。他們使用全基因組測序和先進的計算方法來繪制常見的DNA突變、復雜的結構變異及其時間。

圖1 突變與ecDNA形成尿路上皮癌癥演變的相互作用
“我們的發現定義了驅動膀胱癌進化的新的基本機制——我們現在可以考慮靶向治療的機制,”共同資深作者Bishoy Faltas博士說,他是蓋勒特家族的約翰倫納德醫學博士血液學和醫學腫瘤學研究學者,也是威爾康奈爾醫學院的醫學和細胞與發育生物學副教授,也是紐約長老會/威爾康奈爾醫學中心的腫瘤學家。
紐約基因組中心(New York Genome Center)計算生物學主任Nicolas Robine博士,以及英國精密醫學研究所Olivier Elemento博士,也共同領導了這項研究。共同第一作者是Duy Nguyen和紐約基因組中心的生物信息學科學家William Hooper,以及Weisi Liu博士。
主要治療靶點成為焦點
在美國,膀胱癌的發病率約為每年8萬例。如果發現得早,可以通過手術治愈,但大約30%的病例在晚期才被診斷出來,而晚期的治療難度要大得多。
在這項新研究中,研究人員發現了強有力的證據,證明APOBEC3酶會導致早期突變,而這種突變可能有助于引發這種癌癥的發展。這些酶的進化是通過編輯逆轉錄病毒的病毒DNA來阻止感染逆轉錄病毒,盡管眾所周知,它們有時會使細胞自身的DNA發生突變。
“apobec3誘導的突變在癌癥發生中的確切作用還不清楚,但我們發現這些突變出現在尿路上皮癌的早期,甚至發生在惡性前尿路上皮組織中。”在Faltas實驗室里,Faltas博士專注于研究這些致突變酶在推動癌癥進化中的作用。
研究人員發現,順鉑和其他以鉑為基礎的化療引起進一步的顯著突變爆發,其中一些可能使尿路上皮癌細胞在治療后更好地存活和擴散。
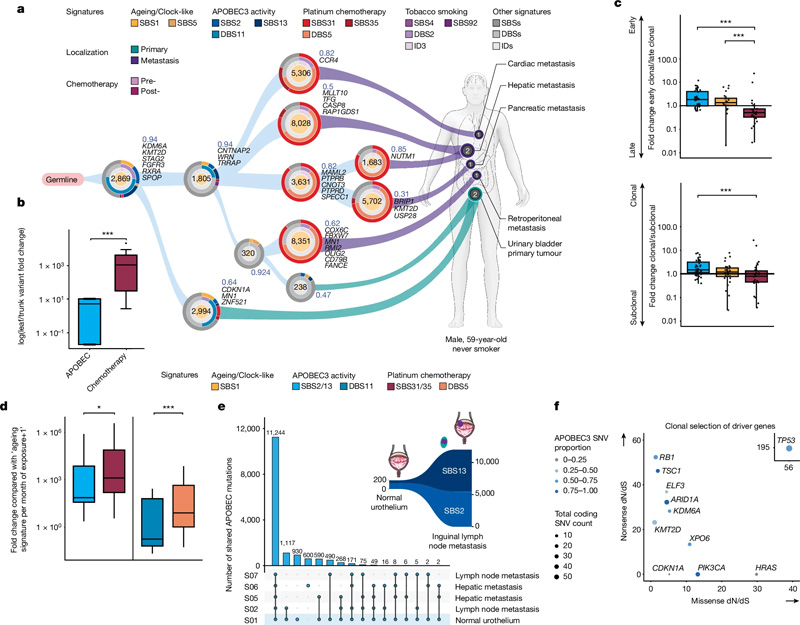
圖2 UC進化中的誘變過程
第三個主要發現是,尿路上皮腫瘤通常包含復雜的DNA重排,從而產生環狀DNA片段。這些“染色體外dna”(ecdna)與細胞核中的染色體分開存在,有時可以攜帶數百個驅動癌癥的生長基因拷貝。研究人員發現,這些ecDNA事件持續存在并變得更加復雜,在治療后合并了新的DNA片段,這表明它們會導致對治療的抵抗。
這促使研究小組在實驗室中對這些基因中的一種稱為CCND1的ecDNA版本進行實驗模擬,CCND1是細胞周期的主要調節因子。這些實驗的結果證實,CCND1在這種染色體外配置驅動治療耐藥性。
總之,這些發現更清晰地描繪了引發和驅動尿路上皮癌的因素。
“傳統上,在分析腫瘤基因組時,我們使用的方法只分析其DNA的一小部分,但我們已經意識到,如果我們對所有的DNA進行測序,并使用智能方法來評估這些數據,還有更多的東西需要發現,”Elemento博士說。“我認為這次合作證明了這一戰略的正確性。”
英格蘭研究所和紐約基因組中心的研究人員正在計劃未來更大規模的合作研究,以更深入地挖掘尿路上皮癌生物學,例如,不僅在大量腫瘤樣本中,而且在單個腫瘤細胞中,對DNA進行全基因組測序,并讀出基因活性。
“在單細胞水平上將這兩組信息結合起來將是非常重要和有趣的”。
研究人員還計劃研究這項工作的潛在臨床應用。研究人員希望FDA批準的一種靶向ERBB2基因產物的新藥物——HER2受體蛋白,也在乳腺腫瘤細胞中發現——對具有強烈ERBB2 ecdna跡象的尿路上皮癌患者尤其有效。他們也在努力尋找阻斷ecDNA形成和維持的方法。
參考資料
[1] The interplay of mutagenesis and ecDNA shapes urothelial cancer evolution
摘要:一項研究揭示了膀胱癌的起源和發展過程
威爾康奈爾醫學院和紐約基因組中心的研究人員領導的一項研究揭示了膀胱癌的起源和發展過程,這是前所未有的。研究人員發現,使正常細胞和癌細胞的DNA發生突變的抗病毒酶是早期膀胱癌發展的關鍵促進因素,而標準化療也是突變的一個有力來源。研究人員還發現,腫瘤細胞中異常環狀DNA結構中過度活躍的基因會導致膀胱癌對治療產生耐藥性。這些發現是對膀胱癌生物學的新見解,并為這種難以治療的癌癥提供了新的治療策略。
這項研究發表在《自然》雜志上,重點研究了膀胱癌的主要形式——尿路上皮癌,它起源于膀胱、尿道和腎臟排尿管的細胞。研究人員檢查了來自同一組處于不同疾病階段的患者的惡性和惡性前尿路上皮細胞。他們使用全基因組測序和先進的計算方法來繪制常見的DNA突變、復雜的結構變異及其時間。

圖1 突變與ecDNA形成尿路上皮癌癥演變的相互作用
“我們的發現定義了驅動膀胱癌進化的新的基本機制——我們現在可以考慮靶向治療的機制,”共同資深作者Bishoy Faltas博士說,他是蓋勒特家族的約翰倫納德醫學博士血液學和醫學腫瘤學研究學者,也是威爾康奈爾醫學院的醫學和細胞與發育生物學副教授,也是紐約長老會/威爾康奈爾醫學中心的腫瘤學家。
紐約基因組中心(New York Genome Center)計算生物學主任Nicolas Robine博士,以及英國精密醫學研究所Olivier Elemento博士,也共同領導了這項研究。共同第一作者是Duy Nguyen和紐約基因組中心的生物信息學科學家William Hooper,以及Weisi Liu博士。
主要治療靶點成為焦點
在美國,膀胱癌的發病率約為每年8萬例。如果發現得早,可以通過手術治愈,但大約30%的病例在晚期才被診斷出來,而晚期的治療難度要大得多。
在這項新研究中,研究人員發現了強有力的證據,證明APOBEC3酶會導致早期突變,而這種突變可能有助于引發這種癌癥的發展。這些酶的進化是通過編輯逆轉錄病毒的病毒DNA來阻止感染逆轉錄病毒,盡管眾所周知,它們有時會使細胞自身的DNA發生突變。
“apobec3誘導的突變在癌癥發生中的確切作用還不清楚,但我們發現這些突變出現在尿路上皮癌的早期,甚至發生在惡性前尿路上皮組織中。”在Faltas實驗室里,Faltas博士專注于研究這些致突變酶在推動癌癥進化中的作用。
研究人員發現,順鉑和其他以鉑為基礎的化療引起進一步的顯著突變爆發,其中一些可能使尿路上皮癌細胞在治療后更好地存活和擴散。

圖2 UC進化中的誘變過程
第三個主要發現是,尿路上皮腫瘤通常包含復雜的DNA重排,從而產生環狀DNA片段。這些“染色體外dna”(ecdna)與細胞核中的染色體分開存在,有時可以攜帶數百個驅動癌癥的生長基因拷貝。研究人員發現,這些ecDNA事件持續存在并變得更加復雜,在治療后合并了新的DNA片段,這表明它們會導致對治療的抵抗。
這促使研究小組在實驗室中對這些基因中的一種稱為CCND1的ecDNA版本進行實驗模擬,CCND1是細胞周期的主要調節因子。這些實驗的結果證實,CCND1在這種染色體外配置驅動治療耐藥性。
總之,這些發現更清晰地描繪了引發和驅動尿路上皮癌的因素。
“傳統上,在分析腫瘤基因組時,我們使用的方法只分析其DNA的一小部分,但我們已經意識到,如果我們對所有的DNA進行測序,并使用智能方法來評估這些數據,還有更多的東西需要發現,”Elemento博士說。“我認為這次合作證明了這一戰略的正確性。”
英格蘭研究所和紐約基因組中心的研究人員正在計劃未來更大規模的合作研究,以更深入地挖掘尿路上皮癌生物學,例如,不僅在大量腫瘤樣本中,而且在單個腫瘤細胞中,對DNA進行全基因組測序,并讀出基因活性。
“在單細胞水平上將這兩組信息結合起來將是非常重要和有趣的”。
研究人員還計劃研究這項工作的潛在臨床應用。研究人員希望FDA批準的一種靶向ERBB2基因產物的新藥物——HER2受體蛋白,也在乳腺腫瘤細胞中發現——對具有強烈ERBB2 ecdna跡象的尿路上皮癌患者尤其有效。他們也在努力尋找阻斷ecDNA形成和維持的方法。
參考資料
[1] The interplay of mutagenesis and ecDNA shapes urothelial cancer evolution



